Содержание
- Виды аллергии на вакцины
- Клинические проявления аллергии на вакцины
- Аллергия на компоненты вакцин
- Можно ли колоть вакцину человеку с аллергией?
- Как диагностировать аллергию на вакцины?
- Порядок вакцинации пациентов с аллергией на вакцины
- Список литературы
Вакцины играют огромную роль в предотвращении целого ряда бактериальных и вирусных заболеваний, включая COVID-19, новую вирусную инфекцию, вызванную SARS-CoV-2, вызвавшую пандемию в мире. Против COVID-19 в России создан целый ряд вакцин – «Спутник V», «Спутник Лайт», «Ковивак», «Эпиваккорона», но люди зачастую опасаются тяжелых побочных эффектов, в том числе – аллергию на вакцины. Тяжелые аллергические реакции на вакцины редки, но труднопредсказуемы, при этом их существование ощутимо затрудняет продвижение идеи вакцинации.
Профилактика вирусного гепатита В у взрослых в домашних условиях
Самая надежная профилактика – это вакцинация. С 2000 года ее проводят всем детям, начиная с рождения. А с недавнего времени и взрослым. Вакцины обеспечивают безопасную и надежную защиту – тесты показывают, что от 90 до 95% прививок здоровых людей приводят к развитию устойчивости к гепатиту B.
Вакцинация против гепатита В безопасна. Побочные эффекты обычно незначительны, чаще всего это болезненность в месте инъекции.
Противопоказание к прививке – аллергия на какие-либо ингредиенты вакцины.
Виды аллергии на вакцины
Всемирная организация по аллергии рекомендовала классифицировать иммунологические реакции на лекарства (включая вакцины) в зависимости от времени появления симптомов]. Эта система определяет два основных типа реакций: немедленную и отсроченную. Этот подход призван отличить опосредованные иммуноглобулином E (IgE) (иммунологические реакции типа I), которые вызывают множество немедленных реакций, от других типов, поскольку эти реакции несут в себе риск опасной для жизни анафилаксии, если пациент повторно подвергнется воздействию.
- Немедленные реакции начинаются в течение первого часа после введения и могут манифестировать в течение нескольких первых минут. IgE-опосредованные реакции наиболее вероятны в течение этого периода времени.
- Отсроченные реакции появляются через несколько часов или дней после приема. Эти реакции могут быть вызваны несколькими различными механизмами, но они редко бывают связанными с IgE.
Клинические проявления аллергии на вакцины
Немедленная, IgE-опосредованная аллергическая реакция может включать различные комбинации из 40 потенциальных симптомов и признаков.
Наиболее частые симптомы и признаки:
- Кожные симптомы, включая покраснение, зуд, крапивницу и ангионевротический отек.
- Респираторные симптомы, включая выделения из носа, заложенность носа, изменение качества голоса, ощущение закрытия горла или удушья, стридор, кашель, хрипы и одышку.
- Сердечно-сосудистые симптомы, включая обморок, обморок, изменение психического статуса, сердцебиение и гипотензию. Анафилаксия (анафилактический шок после вакцинации) – наиболее тяжелая форма IgE-опосредованной аллергической реакции.
Анафилаксия
определяется как системная аллергическая реакция, которая быстро развивается и может привести к смерти. Анафилактические реакции на вакцины возникают редко, их частота по данным активных надзорных исследований колеблется от 0,65 до 1,31 на 1 миллион введенных доз вакцины.
Анафилактический шок происходит чаще всего в течение первых 30 минут после введения вакцины, хотя начало может иногда быть отложено до нескольких часов. Позднее начавшиеся реакции обычно менее серьезны. Реакции, которые происходят через несколько часов или дней после введения вакцины, могут быть связаны с задержкой всасывания аллергенного компонента. Некоторые из этих поздних реакций могут быть причинно связаны не с вакцинацией, а с другим аллергеном, с которым человек столкнулся уже после введения вакцины.
Реакции на вакцину
. Не путать с осложнениями после введения вакцин (поствакцинальными осложнениями, ПВО). Они могут носить как иммунологический, так и неиммунологический характер.
- Лихорадка, повышение температуры тела является обычным после введения вакцины и не препятствуют введению следующих доз этого же препарата (ревакцинация, бустер).
- Местные реакции на вакцинацию, такие как отек и покраснение в месте инъекции, являются обычными и проходят самостоятельно. Это не следует рассматривать как причины для отказа от введения следующих доз вакцины.
- Сывороточная болезнь и реакции
,
похожие на сывороточную болезнь
, включают сыпь, лихорадку, недомогание, - Другие редкие реакции — отсроченные иммунологические реакции включают редкие случаи стойких зудящих узелков в месте инъекции алюминийсодержащих вакцин, которые могут быть связаны с гиперчувствительностью замедленного типа к алюминию. Еще одна редкая реакция — энцефалопатия. Некоторые из этих более серьезных реакций могут являться противопоказаниями к дальнейшим дозам конкретных вакцин.
Местные реакции можно лечить прохладными компрессами в течение первых часов после появления симптомов, парацетамолом или нестероидными противовоспалительными средствами (НПВС), если боль или отек причиняют беспокойство. Однако жаропонижающие средства не следует вводить профилактически, «на всякий случай», поскольку несколько исследований показали, что эти препараты могут снижать иммунный ответ на вакцинацию.
болезненность суставов или полиартрит, возникающие через одну-две недели после вакцинации или раньше, если пациент получал вакцину более одного раза.
Введение вакцины может вызвать вазовагальную реакцию
(потерю сознания), особенно у пациентов, склонные к этой реакции. Вазовагальные реакции характеризуются гипотонией, бледностью, потоотделением, слабостью, тошнотой, рвотой, брадикардией, а в тяжелых случаях — потерей сознания.
Вазовагальные реакции могут имитировать анафилаксию, поскольку оба состояния могут включать гипотензию и коллапс. Однако кожные признаки и симптомы совершенно разные. Обмороку обычно предшествует бледность, тогда как анафилаксия часто начинается с приливов крови и может также включать зуд, крапивницу и ангионевротический отек. При анафилаксии тахикардия встречается чаще, чем брадикардия. Пациентам, которые сообщают об обмороке в прошлом в ответ на вакцинацию, целесообразно вводить вакцины в будущем в положении на спине.
Пути передачи вирусного гепатита В у взрослых
Кровь – главный источник вируса гепатита В. Его также можно найти в других тканях и жидкостях организма, но в более низких концентрациях.
Вирус гепатита В может передаваться несколькими путями.
Через кровь.
Это может произойти в следующих случаях:
- проколы кожи инфицированными иглами, ланцетами, скальпелями или другими острыми предметами;
- прямой контакт с открытыми язвами инфицированного человека;
- брызги инфицированной крови на кожу с мелкими царапинами, ссадинами, ожогами или даже незначительными высыпаниями;
- брызги крови на слизистые оболочки рта, носа или глаз;
- использование чужих зубных щеток или бритв.
Контакт с поверхностями, загрязненными кровью, также может привести к заболеванию, но в меньшей степени.
К слову, вирус может оставаться стабильным в высушенной крови до 7 дней при 25 °C.
Контакт рук с загрязненными кровью поверхностями, такими как лабораторные столы, пробирки или лабораторные инструменты, может передать вирус на кожу или слизистые оболочки.
Через слюну.
Слюна людей с гепатитом B может содержать вирус, но в очень низких концентрациях по сравнению с кровью. И тем не менее, заражение возможно, например, через укусы.
А вот заразиться через посуду или мундштуки (курительные или музыкальных инструментов) невозможно – такие случае не зарегистрированы.
Через сперму или вагинальный секрет.
Гепатит B обнаруживается в сперме и вагинальном секрете. Вирус может передаваться во время незащищенного полового акта и от матери к ребенку во время родов.
Кал, выделения из носа, мокрота, пот, слезы, моча и рвота не участвуют в распространении гепатита B. Если они не загрязнены кровью, риск заражения гепатитом B от этих жидкостей очень низок.
Синовиальная жидкость (смазка для суставов), амниотическая жидкость, спинномозговая жидкость и перитонеальная жидкость (находящаяся в брюшной полости) могут содержать вирус гепатита B, но риск передачи неизвестен.
Гепатит B не распространяется через чихание, кашель, рукопожатия, объятия, поцелуи, кормление грудью, совместное использование столовых приборов, воды или пищи.
Аллергия на компоненты вакцин
Эта фраза указана в качестве противопоказания в инструкциях по медицинскому применению многих вакцин. Но что конкретно она означает, о каких веществах может идти речь? Важно: перечисленный список – общий для вакцинной промышленности, это не означает, что все перечисленные вещества и соединения есть абсолютно во всех вакцинах, конкретный перечень вспомогательных веществ в каждой вакцине отражен в ее инструкции по медицинскому применению.
Желатин
. Добавляют во многие вакцины в качестве стабилизатора, может вызывать анафилактические реакции на вакцины, его содержащие. Нередко у таких людей наблюдается сенсибилизация к альфа-гал (галактозе-альфа-1,3-галактозе), углеводному аллергену, который вызывает аллергию на мясо млекопитающих. У некоторых пациентов регистрировалась клинически выраженная аллергия на говядину и свинину.
Перед введением любой желатинсодержащей вакцины необходимо выяснить наличие в анамнезе аллергии на прием желатина и продуктов, содержащих желатин (например, зефира и мармеладных конфет). Однако отрицательный аллергологический анамнез не исключает возможности развития анафилаксии, так что может потребоваться тестирование на аллергию на желатин.
Лица, которые реагируют на желатин при приеме внутрь, должны быть обследованы аллергологом до введения вакцины. Если в анамнезе имеется аллергическая реакция немедленного типа на желатин и это подтверждается кожными тестами или сывороточными тестами IgE к желатину, целесообразно провести кожную пробу таких пациентов с желатинсодержащими вакцинами перед их введением. Если кожные пробы на вакцину отрицательны, ее можно ввести обычным способом, но после этого пациент должен оставаться под наблюдением в течение как минимум 30 минут. Если кожные пробы вакцины положительны, вакцину можно вводить градуированными дозами. В качестве альтернативы рекомендовано использовать вакцины, не содержащие желатин, если таковые имеются в доступе.
Частота аллергических реакций на желатин в вакцинах была особенно высока в Японии, и этот феномен впоследствии отчасти приписали генетическим характеристикам населения. Японские производители удалили желатин из некоторых вакцин и перешли на более тщательно гидролизованный желатин в других, что резко снизило частоту реакций. Эти стратегии по-разному применялись в других странах, так что реакции на желатин в вакцинах все еще имеют место быть.
Яичный белок
присутствует в вакцинах против желтой лихорадки, MMR, а также в некоторых вакцинах против гриппа и бешенства. Однако это количество потенциально имеет клиническое значение только в вакцине против желтой лихорадки. Вакцины MMR и против бешенства можно безопасно вводить обычным способом пациентам с аллергией на яйца.
Перед введением вакцины против желтой лихорадки следует выяснить наличие в анамнезе аллергии после употребления яиц, сырых или приготовленных, а лиц с положительным анамнезом обследовать аллерголог. Таким пациентам перед введением следует пройти кожный тест с вакциной против желтой лихорадки. Если кожные пробы на вакцину отрицательны, вакцину можно ввести обычным способом, но после этого пациент должен оставаться под наблюдением в течение как минимум 30 минут. Если кожные пробы вакцины положительны, вакцину можно вводить градуированными дозами.
Коровье молоко
. Казеин, аллергенный белок, содержащийся в коровьем молоке, был предварительно причастен к анафилаксии против дифтерийной, столбнячной и коклюшной вакцин (DTaP или Tdap) у небольшого числа детей с тяжелой аллергией на молоко. Такие вакцины готовят в среде, полученной из белка коровьего молока, и в этих препаратах были продемонстрированы количества остаточного казеина в нанограммах. Однако подавляющее большинство пациентов с тяжелой аллергией на молоко не имеет аллергических реакций на подобные вакцины.
Тимеросал, алюминий и феноксиэтанол
добавляются к некоторым вакцинам в качестве консервантов, хотя использование тимеросала (который содержит ртуть) в вакцинах резко сократилось из-за теоретических опасений по поводу кумулятивного воздействия ртути на детей. Документально не подтверждено, что эти консерванты вызывают аллергические реакции немедленного типа на вакцины, а кожные пробы немедленного типа обычно не показаны.
Некоторые противомикробные препараты
могут быть добавлены в следовых количествах к вакцинам, чаще всего это неомицин, полимиксин В, и стрептомицина. Хотя нет конкретных сообщений об анафилаксии, вызванной вакциной, причиной которой были эти препараты, редкие пациенты, у которых были подтверждены анафилактические реакции, вызванные этими антибиотиками, не должны получать вакцины, содержащие их, без предварительной оценки аллерголога.
Латекс
. «Резина» в пробках флаконов с вакциной или поршнях шприцев может быть либо латексом из сухого натурального каучука (DNR), либо синтетическим каучуком. Те, которые сделаны из латекса, несут теоретический риск для пациентов с аллергией на латекс, либо в результате жидкого раствора вакцины, извлекающего латексные аллергены из пробки при физическом контакте, либо в результате прохождения иглы через пробку и удержания латексного аллергена внутри или на игле. Одно сообщение об анафилактической реакции после введения вакцины против гепатита В пациенту с аллергией на латекс было связано с резиной в пробке. Обзор > 160 000 отчетов из Системы сообщений о побочных эффектах вакцин США (VAERS) выявил только 28 случаев возможных аллергических реакций немедленного типа после получения вакцины, содержащей DNR, и они могли быть вызваны другими компонентами. Содержание латекса в упаковке вакцины можно найти в инструкции по медицинскому применению.
Пациенты с анафилаксией на латекс могут безопасно получать вакцины из флаконов с пробками без DNR. Если единственный доступный препарат имеет латексную пробку, пробку следует удалить и набрать вакцину непосредственно из флакона, не пропуская иглу через пробку. Если единственная доступная вакцина содержит латекс в упаковке, чего нельзя избежать, например, в предварительно заполненном шприце, вакцину все равно можно вводить, но после этого за пациентом следует наблюдать не менее 30 минут.
В отличие от пациентов с латекс-индуцированной анафилаксией, пациенты с контактной аллергией на латекс, например, дерматитом рук, могут безопасно получать вакцины из флаконов с латексными пробками.
Дрожжи
. Некоторые вакцины содержат дрожжевой белок, в том числе вакцины против гепатита В (до 25 мг на дозу) и 4- и 9-валентные вакцины против вируса папилломы человека (<7 мкг на дозу), но побочные реакции на них, если таковые имеются, фиксируются редко. Сама по себе аллергия на дрожжи встречается очень редко, но если у пациента в анамнезе есть клиническая реактивность на пекарские или пивные дрожжи и положительный кожный тест на Saccharomyces cerevisiae, перед введением вакцины было бы целесообразно провести кожную пробу. Если кожные пробы отрицательны, вакцину можно ввести обычным способом, но после этого пациента необходимо наблюдать как минимум 30 минут. Если кожные пробы положительны, вакцину можно вводить градуированными дозами.
Декстран
вызывает аллергические реакции на конкретную марку вакцины MMR, ранее использовавшуюся в Италии и Бразилии. Реакции были связаны с присутствием IgG к декстрану, и предполагалось, что механизмом является активация системы комплемента и высвобождение анафилатоксина. Эта марка вакцины была отозвана с рынка, хотя декстран спорадически встречается в других вакцинах (например, в некоторых ротавирусных вакцинах).
Проблемы вакцинации детей с аллергическими заболеваниями
Единственным способом снижения заболеваемости инфекциями, управляемыми вакцинацией, и предотвращения развития эпидемий на современном этапе является 95% охват населения профилактическими прививками. Это означает, что вакцинации подлежат не только здоровые, но и страдающие различными заболеваниями дети.
Существующее мнение о том, что вакцины «аллергизируют», правомерно лишь в отношении некоторых содержащихся в них субстанций. Прогресс в производстве вакцин освобождает их в большей степени от балластных веществ: вследствие лучшей очистки все включенные в Национальный календарь прививок вакцины содержат намного меньше антигенов, чем вакцины в 20–30-х годах. Как живые, так и инактивированные вакцины практически не стимулируют стойкого повышения уровня IgE и продукцию специфических IgE-антител.
Широкая распространенность аллергопатологии у детей, ежегодное увеличение числа больных в детской популяции, ранний, часто на первом году жизни, дебют и хронический характер болезни привели к тому, что у педиатров постоянно возникает необходимость вакцинации детей с аллергическими заболеваниями. В настоящее время отношение к вакцинации детей с аллергопатологией кардинально изменилось в лучшую сторону. Однако недостаток личного опыта практических врачей, как в тактике лечения таких детей, так и в подходах к проведению профилактических прививок при различных формах и тяжести течения заболевания ставит врача в затруднительное положение при необходимости выбора тактики вакцинации этих пациентов.
Принимая решение о сроках вакцинации, объеме медикаментозной подготовки и выборе вакцинного препарата, необходимо учитывать спектр сенсибилизации, нозологическую форму и стадию заболевания, то есть в основе тактики вакцинации детей с аллергическими заболеваниями лежит индивидуальный подход к каждому ребенку. Однако, невзирая на полиморфизм проявлений атопии, при иммунизации этих детей руководствуются рядом общих принципов:
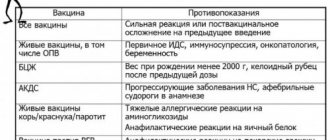
- Дети с аллергическими заболеваниями подлежат вакцинации от всех инфекций, включенных в календарь профилактических прививок (туберкулез, вирусный гепатит В, дифтерия, столбняк, коклюш, полиомиелит, корь, эпидемический паротит, краснуха) согласно имеющимся инструктивным документам. Для иммунизации используются как отечественные, так и зарубежные вакцинные препараты. При этом предпочтение отдается комбинированным вакцинам (например, дивакцина корь-паротит или тривакцины («Приорикс», «М-М-РII») против кори, эпидемического паротита и краснухи), что позволяет снизить суммарный объем вводимых консервантов.
- В большинстве случаев для детей с аллергическими заболеваниями, особенно при поражении респираторного тракта, целесообразно расширить календарь профилактических прививок за счет ежегодной вакцинации против гриппа, а также — против пневмококковой и гемофильной инфекций. Вакцинация против этих инфекций приводит не только к снижению частоты и тяжести интеркуррентных заболеваний, но и способствует положительной динамике течения основного заболевания, позволяя добиться уменьшения объема базисной терапии и удлинения периода ремиссии. Введение дополнительных вакцинных препаратов можно сочетать с вакцинами основного календаря прививок.
- Наличие в анамнезе у детей с аллергическими заболеваниями системных аллергических реакций на антибиотики, содержащиеся в вакцинах, и на антигены субстрата культивирования (в частности, белок куриного и/или перепелиного яйца) является противопоказанием для введения коревой и паротитной вакцин. Выявление убольных выраженной аллергии к белкам куриного яйца также является противопоказанием для прививок гриппозными вакцинами против клещевого энцефалита, приготовленными на курином субстрате.
Важно помнить о том, что наличие документированной аллергии на перечисленные компоненты не является однозначным противопоказанием к иммунизации вакцинами, их содержащими, важен и характер этих реакций. К примеру, если при попытке съесть яйцо немедленно возникает отек губы либо анафилактическая реакция, то вакцинация абсолютно противопоказана. Если же аллергия проявляется реакциями незначительной тяжести, то в большинстве случаев таких пациентов можно прививать на фоне профилактического приема противоаллергических средств.
Тяжелые аллергические реакции на пекарские дрожжи могут служить противопоказанием для вакцинации против вирусного гепатита В, т.к. дрожжи используются в процессе производства основного антигена и в чисто символических количествах могут встречаться в вакцинах.
- Вакцинацию детей с аллергическими заболеваниями проводят при достижении полной или частичной ремиссии, в последнем случае речь идет о сохранении у больного неярких клинических проявлений без признаков обострения заболевания.
Детям, страдающим поллинозом, профилактические прививки делают вне сезона пыления причинно-значимых растений.
Вакцинация детей с аллергическими заболеваниями, не имеющими сезонного характера, проводится в любое время года, однако детей, часто болеющих респираторными инфекциями, с учетом эпидемической ситуации желательно вакцинировать в теплое года, вне периода высокой заболеваемости острыми респираторными вирусными инфекциями (ОРВИ). Развитие ОРВИ у кого-либо из членов семьи при благополучной эпидситуации служит основанием для временного (до их выздоровления) освобождения от профилактических прививок детей с аллергическими заболеваниями.
По эпидемическим показаниям дети с аллергопатологией могут быть вакцинированы и в период обострения заболевания. В таких случаях вакцинация проводится под наблюдением аллерголога-иммунолога.
- Профилактические прививки детям с указанной патологией следует проводить на фоне базисной терапии, объем и длительность которой зависят от периода и тяжести аллергического заболевания. Следует подчеркнуть, что длительное применение топических глюкокортикостероидных препаратов (ингаляционно, эндоназально, конъюнктивально или накожно) не является противопоказанием к введению вакцинных препаратов.
Во всех случаях в течение 3–5 дней до и после вакцинации назначают один из антимедиаторных препаратов в возрастной дозировке, предпочтение отдается препаратам 2 и 3 поколения. В случае введения живых вакцин (в связи с более поздним проявлением побочных реакций) применение антигистаминных препаратов может продолжаться в течение 2–3 недель после прививки.
- Фактором высокого риска возникновения тяжелых проявлений аллергии на вакцинные препараты считается развитие в поствакцинальном периоде системных аллергических реакций в виде генерализованной крапивницы, отеков Квинке, анафилактического шока. Дети, у которых возник анафилактический шок на введение вакцины, подлежат отводу от последующей иммунизации данным препаратом. Вопрос о продолжении иммунизации детей, имеющих в поствакцинальном периоде системные проявления аллергии в виде крапивницы и аллергических отеков, решается в каждом конкретном случае индивидуально, после консультации аллерголога. По эпидемиологическим показаниям такие дети могут быть ревакцинированы в период ремиссии аллергического заболевания на фоне превентивной противоаллергической терапии, включающей парентеральное введение антигистаминных препаратов, глюкокортикостероидов, адреналина непосредственно перед введением вакцины.
- Профилактические прививки детям с аллергическими заболеваниями следует проводить в кабинетах иммунопрофилактики, в прививочных кабинетах, фельдшерско-акушерских пунктах (ФАП) или в стационарах при наличии средств противошоковой терапии. После каждой вакцинации ребенок должен находиться под наблюдением медицинского персонала не менее 30 минут, поскольку в этот период могут развиться системные аллергические реакции немедленного типа, наиболее опасные для больного.
- В период вакцинации детям рекомендовано соблюдать диету с исключением облигатных аллергенов и гистаминолибераторов (рыба, яйца, мед, шоколад, орехи, какао, цитрусовые, клубника, земляника), а также воздержаться от приема других продуктов, на которые ранее отмечались аллергические реакции, не включая при этом в рацион питания новых продуктов. Диета соблюдается в течение не менее 1 недели до вакцинации и 1–3 месяцев после нее (в зависимости от вида вакцинного препарата и течения поствакцинального периода).
- Кожные пробы с неинфекционными и инфекционными аллергенами могут быть выполнены за 1,5 недели до введения вакцинных препаратов или спустя 1–1,5 месяца после него.
- Если ребенок получает курс аллергенспецифической иммунотерапии, а также курс терапии Гистаглобулином, Аллергоглобулином или Противоаллергическим иммуноглобулином, то вакцинацию следует проводить не ранее чем через 1–1,5 месяца после завершения курса лечения, за исключением ситуации, обусловленной эпидпоказаниями. После введения вакцинных препаратов курсы терапии могут быть начаты не ранее чем через 1 месяц (при введении живых вирусных вакцин— через 1,5–2 месяца).
- После постановки пробы Манту введение вакцинных препаратов (за исключением БЦЖ и БЦЖ-М) рекомендуется проводить не ранее чем через 10–12 дней, поскольку у большинства детей с аллергической патологией наблюдается положительная реакция на туберкулин, свидетельствующая о наличии аллергически измененной реактивности у ребенка, при иммунизации по эпидпоказаниям этот срок может быть меньше. После введения АКДС-вакцины, АДС, АДС-М-анатоксинов, ЖКВ (живая коревая вакцина) и вакцины против эпидемического паротита пробу Манту можно ставить не ранее чем через 1,5 месяца, т.е. периода восстановления показателей иммунологического статуса у детей с аллергическими заболеваниями.
- Детям с нарушенным графиком вакцинации, имевшим в анамнезе одну прививку АКДС-вакцины или АДС, АДС-М-анатоксинов, независимо от времени, прошедшего после нее, достаточно ввести еще одну дозу АДС или АДС-М-анатоксина с последующей ревакцинацией через 6 месяцев. Выбор вакцинного препарата зависит от возраста ребенка. Если дети имеют в анамнезе две прививки АКДС-вакциной или АДС, АДС-М-анатоксином, также следует проводить ревакцинацию АДС или АДС-М-анатоксином без учета времени, прошедшего после последней прививки, но не ранее чем через 6–12 месяцев.
- Опыт вакцинации детей с аллергическими заболеваниями, накопленный нами за многолетнюю практику (с 1984 г. по настоящее время) в лаборатории вакцинопрофилактики и иммунотерапии аллергических заболеваний ГУ НИИ вакцин и сывороток им. И.И.Мечникова РАМН, свидетельствует о том, что иммунизация, проведенная в период полной ремиссии заболевания в соответствии с вышеизложенными рекомендациями, практически не сопровождается поствакцинальными осложнениями или обострением аллергопатологии.
Умеренное обострение основного заболевания зарегистрировано только у больных с атопическим дерматитом, у которых вакцинацию проводили при неустойчивой ремиссии или при подостром течении. Частота обострения атопического дерматита составила 8,6% после введения АКДС-вакцины, 10–21%— после иммунизации АДС-М-анатоксином, 4,5%— после прививок против кори и эпидемического паротита. Проведенная иммунизация не ухудшала течение аллергического заболевания. Наш опыт показал, что такие проявления отличались кратковременностью и не отражались на течении поствакцинального периода при последующей иммунизации.
Клиническое наблюдение за больными с бронхиальной астмой в поствакцинальном периоде показало, что ни в одной из наблюдаемых групп не возникло приступов астмы. Исследование бронхиальной проходимости у 195 больных старше 5 лет на протяжении полного курса иммунизации АДС-М-анатоксином подтвердило, что вакцинация не приводит к обострению основного заболевания даже при наличии явных или скрытых признаков бронхоспазма. Общие легкие и среднетяжелые реакции регистрировали у 30 (14,5%) больных, аллергические сыпи слабой выраженности— у 10 (2,9%) больных, местные инфильтраты размером 55 см— у 15 (4,4%) детей, сочетание общих и местных реакций— в 10 (2,9%) случаях. Вероятность их возникновения не зависела от длительности периода ремиссии и соответствовала таковой при вакцинации АДС-М-анатоксином здоровых детей. Терапия, назначенная в поствакцинальном периоде с учетом данных спирографии и клинической картины, не только предупреждала развитие повторных приступов БА, но и, в ряде случаев, способствовала временной нормализации бронхиальной проходимости. Так, у больных, имеющих до вакцинации признаки бронхообструкции, в поствакцинальном периоде показатели бронхиальной проходимости нормализовались исохранялись таковыми более 6 месяцев.
Нами были вакцинированы против дифтерии и столбняка дети, имеющие в анамнезе аллергическую крапивницу и отек Квинке. Клиническое наблюдение, проводившееся в поствакцинальном периоде в течение 6–12 месяцев, не выявило ни одного случая повторного возникновения отека Квинке и крапивницы, несмотря на то, что продолжительность периода ремиссии заболевания к моменту проведения прививок варьировала от 1 недели до 3 и более месяцев.
При анализе реакций, возникших у детей с аллергическими заболеваниями в течение одного месяца после введения противокоревой вакцины по индивидуальной схеме, удалось выявить лишь слабовыраженную аллергическую сыпь в первую неделю после вакцинации у 10,6% привитых длительностью в 4–5 дней, и только у одного пациента отметили умеренное обострение дерматита в течение одной недели. Среди детей с бронхиальной астмой и поллинозом вакцинация не сопровождалась обострением заболевания или возникновением каких-либо аллергических реакций. В настоящее время имеются данные дополнительных исследований, подтверждающие, что вакцинация против кори детей с бронхиальной астмой любой степени тяжести безопасна и эффективна, если проводится на фоне лечения основного заболевания.
Известно, что больные аллергией больше подвержены заболеванию туберкулезом, а среди больных туберкулезом аллергическая патология встречается в 4 раза чаще, чем у не болеющих лиц. Сочетание туберкулеза с бронхиальной астмой обусловливает особенно тяжелое течение последней. Таким образом, возможно, именно больным БА особенно показана противотуберкулезная вакцинация и ревакцинация. Для ревакцинации против туберкулеза детей, страдающих аллергической патологией, применяют БЦЖ-М-вакцину. Ревакцинация, проведенная впериод стойкой ремиссии аллергического процесса, не сопровождается обострением основного заболевания. Вакцина БЦЖ-М, помимо специфического защитного, оказывает выраженное иммуномоделирующее воздействие, что, в свою очередь, способствует уменьшению частоты случаев развития интеркуррентных ОРВИ и связанных с ними обострений бронхиальной астмы.
Полный курс вакцинации против гепатита В был проведен 40% детей с атопическим дерматитом, 30%— с бронхиальной астмой, 20%— с сезонным и круглогодичным аллергическим риноконъюнктивитом, 10%— с крапивницей иотеком Квинке при различной тяжести течения основного заболевания на фоне базисной терапии. В поствакцинальном периоде не отмечали возникновения необычных реакций и осложнений, в том числе и обострения основного заболевания.
Дети с аллергическими заболеваниями, особенно страдающие бронхиальной астмой, нуждаются в защите от острых респираторных инфекций, в т.ч. гриппа. По рекомендации ВОЗ все пациенты с бронхиальной астмой ежегодно должны быть вакцинированы против гриппа, независимо от формы и тяжести течения заболевания, проводимой лекарственной терапии. Нами не выявлено повторных приступов астмы в поствакцинальном периоде или возникновения других реакций на фоне вакцинации против гриппа. Исследования не продемонстрировали ухудшения функции внешнего дыхания, усиления симптомов астмы и интенсивности использования лекарственной терапии. Местные реакции (в виде болезненности в месте введения вакцины) и общая легкая реакция (повышение температуры до 37–37,2°С) выявлены в 10% случаев, при этом медикаментозного лечения не потребовалось. В 2% случаев развилась аллергическая сыпь, которая быстро исчезла на фоне применения Кларитина. При наблюдении за детьми в течение 6 месяцев после вакцинации в 5% случаев отмечено присоединение ОРВИ (серологическая идентификация не проводилась). Для сравнения— за аналогичный период времени до вакцинации дети переносили ОРВИ 3–6 раз в год.
Наиболее эффективным у детей с бронхиальной астмой оказалось сочетанное применение вакцин против гриппа и пневмококковой инфекции. При вакцинации препаратами «Ваксигрип» и «Пневмо 23» детей с различной тяжестью течения бронхиальной астмы отмечено снижение частоты обострений заболевания в 1,7 раза, числа интеркуррентных респираторных инфекций в 2,5 раза и улучшение показателей функции внешнего дыхания (ОФВ1, СОС25–75 и СОС75–85). В то же время в динамике вакцинального процесса не выявлено изменений содержания эозинофилов в периферической крови и результатов скарификационных кожных проб.
Вакцинация против менингококковой инфекции серогрупп А+С рекомендуется нами всем детям после завершения полного курса вакцинации, согласно национальному календарю прививок. Как правило, это совпадает с поступлением ребенка в детский сад и, реже, в школу. Под нашим наблюдением находились более 120 детей различного возраста (старше двух лет) с различными аллергическими заболеваниями. Вакцинация проводилась препаратом «Полисахаридная менингококковая вакцина А+С» в период ремиссии заболевания и, как всегда, на фоне короткого курса антимедиаторных препаратов. В клиническом аспекте введение Полисахаридной менингококковой вакцины А+С, как и любой другой полисахаридной вакцины, сопровождалось возникновением слабовыраженных местных реакций (не более чем в 3–4% случаев) и почти такой же частотой общих легких температурных реакций. Аллергические заболевания на фоне вакцинации не обострялись.
Характерно, что концентрация общего IgE в поствакцинальном периоде повышалась кратковременно и через 1,5–2 месяца возвращалась к исходным значениям. Транзиторный прирост уровня общего IgE наблюдался преимущественно у детей, имевших в поствакцинальном периоде общие или местные аллергические реакции.
Введение вакцинных препаратов детям с аллергическими заболеваниями сопровождается синтезом антител к вакцинным антигенам на уровне протекивных значений, как у здоровых детей.
Таким образом, проведенные исследования не только подтверждают возможность, но и указывают на необходимость активной иммунизации детей с аллергопатологией. Аллергические заболевания являются скорее показанием к вакцинации, чем противопоказанием, поскольку у этих детей инфекции протекают особенно тяжело (например, коклюш у больного астмой). Педиатр, консультируя такого ребенка с аллергологом, должен ставить вопрос не о допустимости прививок, а о выборе оптимального времени их проведения и необходимости лекарственной защиты (противогистаминные препараты при кожных формах атопии, ингаляции стероидов и бета-агонистов при астме).
Следует подчеркнуть, что ни наличие аллергопатологии, ни развитие поствакцинальных реакций или обострения аллергического заболевания после введения вакцинных препаратов не являются абсолютным противопоказанием кпроведению профилактических прививок вдальнейшем.
Литература
- Медуницин Н.В. Вакцинология. М.: Триада-Х. 1999. 272 с.
- Основы вакцинопрофилактики у детей с хронической патологией / Под ред. М.П.Костинова. М.: Медицина для всех. 2002. 320 с.
- Марцишевская Е.А. Клинико-иммунологическая характеристика коревого вакцинального процесса у детей с бронхиальной астмой. Автореф. канд. мед. наук. СПб. 2001. 22 с.
- Пухлик Б.М. Взаимосвязь между туберкулезом и аллергическими заболеваниями // Пробл. туберк. 1983. № 11. С. 29–32.
- Ala’Eldin H., Ahmed A., Karl G. et al. Influenza vaccination in patients with asthma: effect on peak expiratory flow, asthma symptoms and use of medication. Vaccine 1997; 15: 1008–1009.
- Маркова Т.П., Чувиров Д.Г. Применение вакцины «Инфлювак» для профилактики гриппа у детей с аллергическими заболеваниями // Российский вестник перенатологии и педиатрии. 2001.
- Карпочева С.В., Андреева Н.П., Магаршак О.О. и др. Течение бронхиальной ас и «Ваксигрип» // XIII Российский национальный конгресс «Человек и лекарство»: Тезисы докладов. М. 2006. С. 534.
- Методические указания № 3.3.1.1095-02. Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок.
О. О. Магаршак, кандидат медицинских наук М. П. Костинов, доктор медицинских наук, профессор НИИ вакцин и сывороток им. И.
И Мечникова РАМН, Москва
Источник: ЛЕЧАЩИЙ ВРАЧ
Можно ли колоть вакцину человеку с аллергией?
Диагностический подход отличается для пациента, который прореагировал на компонент вакцины, такой как желатин, яйца, латекс или дрожжи, но не на само действующее вещество. Часто встречается следующая ситуация: вакцинация от гриппа пациента с аллергией на яйца, которая протекает успешно и без осложнений.
На какие клинические вопросы следует ответить перед тем, как вакцинировать пациента с аллергией?
- Соответствуют ли природа проявлений и время появления анафилактической анафилаксии? Похоже ли это на клиническую картину, опосредованную IgE?
- Есть ли в анамнезе подобная реакция? Важно получить эту информацию и разобраться, была ли она вызвана антигенным материалом вакцины или вспомогательными веществами. Различные компоненты вакцины четко перечислены в инструкциях по медицинскому применению, поставляемых производителями. Если реакция произошла после первой дозой вакцины, вероятность того, что сам иммунизирующий агент является аллергеном, значительно снижается. В этой клинической ситуации медицинские работники также должны узнать об аллергических реакциях на пищу, особенно на желатин.
- Есть ли потребность в будущих дозах этой вакцины или других вакцин с общими компонентами? После получения в анамнезе реакции на вакцину, произошедшей вскоре после введения, которая согласуется с IgE-опосредованной реакцией, клиницист должен определить, требуются ли будущие дозы подозреваемой вакцины или других вакцин с общими компонентами. Учитывая возможность перекрестной реакции с общими компонентами в других вакцинах и с пищевыми продуктами, целесообразна тщательная оценка, даже если не требуются дополнительные дозы потенциально аллергенной вакцины.
Как диагностировать аллергию на вакцины?
Если пациенту предстоит получить дополнительные дозы вакцины, необходимо провести кожное тестирование с использованием этой самой вакцины. Правильное выполнение и интерпретация кожных проб требует опыта в этой процедуре, включая использование соответствующих положительных и отрицательных контролей. Кроме того, сами кожные пробы редко могут вызывать анафилактические реакции у людей с сильной аллергией. Таким образом, кожные пробы должны проводиться только лицами, такими как аллергологи, имеющими подготовку по интерпретации и лечению возможных реакций на тесты, и только в условиях, когда анафилактические реакции можно распознать и быстро купировать.
Вакцина должна быть сначала проверены методом укола кожи. Полноценную вакцину можно использовать, если история реакции не была действительно опасной для жизни; в этом случае целесообразно разбавить вакцину перед кожным уколом.
Если полный укол отрицательный, следует провести внутрикожный тест с вакциной, разведенной 1: 100 в 0,9-процентном (изотоническом) физиологическом растворе, снова с соответствующими положительными и отрицательными контролями.
Интерпретация кожных проб на вакцины. Аллергологический анамнез критически важен для интерпретации кожных проб на вакцины. Возможны клинически нерелевантные положительные кожные пробы, как и при кожных пробах на любой аллерген. Наличие положительной кожной пробы на вакцину не обязательно указывает на последующую реакцию, хотя ее следует рассматривать как значительный фактор риска.
Вакцины могут индуцировать выработку IgE в первые дни или недели после вакцинации, хотя клиническое значение этого неясно. Специфический IgE к дифтерийным (DT) и столбнячным токсоидам был индуцирован вакцинацией и, как было установлено, сохраняется в течение как минимум двух лет после иммунизации. Этот специфический IgE не был связан с аллергическими реакциями при последующей вакцинации.
Также возможны раздражающие (ложноположительные) реакции на кожные пробы, особенно при внутрикожных пробах в концентрациях 1:10 или в неразбавленном виде. В одном исследовании с участием 20 взрослых добровольцев, не имевших в анамнезе реакций на вакцины, оценивалась реакция на кожный укол и внутрикожное тестирование с 10 распространенными вакцинами. Раздражающие реакции не наблюдались при тестировании на кожные уколы и были необычными после внутрикожного тестирования с концентрацией 1: 100. Однако они были обычным явлением при более высоких внутрикожных концентрациях (1:10 или в неразбавленном виде). Таким образом, внутрикожное тестирование вакцин следует проводить только в концентрации 1: 100.
Отсроченные реакции. Наблюдались реакции гиперчувствительности замедленного типа в месте кожной пробы (особенно внутрикожной) с вакциной. Эти реакции не имеют отношения к диагностике IgE-опосредованной аллергии на вакцину.
Тестирование компонентов вакцины. Если подозреваемая вакцина содержит яйца, желатин, латекс или дрожжи Saccharomyces cerevisiae, пациенту следует также пройти тестирование кожи на следующие компоненты:
Кожные уколы:
- Экстракты яиц и дрожжей Saccharomyces cerevisiae для кожных проб.
- Экстракт желатина можно приготовить путем растворения 1 чайной ложки засахаренного желатинового порошка любого цвета или вкуса в 5 мл физиологического раствора для создания раствора для кожных тестов.
- Стандартизированные экстракты латекса натурального каучука (NRL).
Измерение аллерген-специфического IgE в сыворотке:
- Специфический IgE к яйцам, желатину, латексу и дрожжам можно измерить в сыворотке с помощью иммуноанализов. Чувствительность латексных тестов ImmunoCAP и Immulite составляет примерно 80 %.
Терапия острых аллергических состояний на догоспитальном этапе
К острым аллергическим заболеваниям относят анафилактический шок, обострение (приступ) бронхиальной астмы, острый стеноз гортани, отек Квинке, крапивницу, обострение аллергического конъюнктивита и/или аллергического ринита. Считается, что аллергическими заболеваниями страдает в среднем около 10% населения земного шара. Особую тревогу вызывают данные ННПО скорой медицинской помощи, согласно которым за последние 3 года число вызовов по поводу острых аллергических заболеваний в целом по РФ возросло на 18%.
Основные причины возникновения и патогенез
Патогенез аллергических реакций на сегодняшний день достаточно полно изучен и подробно описан во многих отечественных и зарубежных монографиях по аллергологии и клинической иммунологии. Центральная роль в реализации иммунопатологических реакций принадлежит иммуноглобулинам класса Е (IgE), связывание которых с антигеном приводит к выбросу из тучных клеток медиаторов аллергии (гистамина, серотонина, цитокинов и др.).
Наиболее часто аллергические реакции развиваются при воздействии ингаляционных аллергенов жилищ, эпидермальных, пыльцевых, пищевых аллергенов, лекарственных средств, антигенов паразитов, а также при укусах насекомых. Лекарственная аллергия чаще всего развивается при применении анальгетиков, сульфаниламидов и антибиотиков из группы пенициллинов, реже цефалоспоринов (при этом следует учитывать риск перекрестной сенсибилизации к пенициллину и цефалоспоринам, составляющий от 2 до 25%). Кроме того, в настоящее время возросло число случаев развития латексной аллергии.
Клиническая картина, классификация и диагностические критерии
С точки зрения определения объема необходимой лекарственной терапии на догоспитальном этапе оказания помощи и оценки прогноза острые аллергические заболевания можно подразделить на легкие (аллергический ринит — круглогодичный или сезонный, аллергический конъюнктивит — круглогодичный или сезонный, крапивница), средней тяжести и тяжелые (генерализованная крапивница, отек Квинке, острый стеноз гортани, среднетяжелое обострение бронхиальной астмы, анафилактический шок). Классификация и клиническая картина острых аллергических заболеваний представлены в табл. 1.
При анализе клинической картины аллергической реакции врач СМП должен получить ответы на следующие вопросы (табл. 2).
При начальном осмотре на догоспитальном этапе следует оценить наличие стридора, диспноэ, свистящего дыхания, одышки или апноэ; гипотензии или синкопе; изменений на коже (высыпаний по типу крапивницы, отека Квинке, гиперемии, зуда); гастроинтестинальных проявлений (тошноты, болей в животе, диареи); изменений сознания. Если у больного отмечаются стридор, выраженная одышка, гипотензия, аритмия, судороги, потеря сознания или шок, то данное состояние рассматривается как угрожающее жизни.
Лечение острых аллергических заболеваний
При острых аллергических заболеваниях на догоспитальном этапе неотложная терапия строится по следующим направлениям:
Прекращение дальнейшего поступления в организм предполагаемого аллергена.
Например, в случае реакции на лекарственный препарат, введенный парентерально, или при укусах насекомых — наложение жгута выше места инъекции (или укуса) на 25 мин (каждые 10 мин необходимо ослаблять жгут на 1-2 мин); к месту инъекции или укуса прикладывается лед или грелка с холодной водой на 15 мин; обкалывание в 5-6 точках и инфильтрация места инъекции или укуса 0,3-0,5 мл 0,1%-ного раствора адреналина с 4,5 мл изотонического раствора хлорида натрия.
Противоаллергическая терапия (антигистаминными препаратами или глюкокортикостероидами).
Введение антигистаминных препаратов (блокаторов Н1-гистаминовых рецепторов) показано при аллергическом рините, аллергическом конъюнктивите, крапивнице. Выделяют классические антигистаминные препараты (например, супрастин, димедрол) и препараты нового поколения (семпрекс, телфаст, кларотадин и др.). Необходимо отметить, что для классических антигистаминных препаратов в отличие от препаратов нового поколения характерно короткое время воздействия при относительно быстром наступлении клинического эффекта; многие из этих средств выпускаются в парентеральных формах. Антигистаминные препараты нового поколения лишены кардиотоксического действия, конкурентно влияют на гистамин, не метаболизируются печенью (например, фармакокинетика семпрекса не меняется даже у больных с нарушенными функциями печени и почек) и не вызывают тахифилаксии. Эти препараты обладают длительным воздействием и предназначаются для приема внутрь.
При анафилактическом шоке и при отеке Квинке (в последнем случае — препарат выбора) внутривенно вводится преднизолон (взрослым — 60-150 мг, детям — из расчета 2 мг на 1 кг массы тела). При генерализованной крапивнице или при сочетании крапивницы с отеком Квинке высокоэффективен бетаметазон (дипроспан в дозе 1-2 мл внутримышечно), состоящий из динатрия фосфата (обеспечивает быстрое достижение эффекта) и дипропионата бетаметазона (обусловливает пролонгированное действие). Для лечения бронхиальной астмы, аллергического ринита, аллергического конъюнктивита разработаны топические формы глюкокортикостероидов (флутиказон, будесонид). При отеке Квинке для предупреждения влияния на ткани гистамина необходимо комбинировать антигистаминные препараты нового поколения (семпрекс, кларитин, кларотадин) с глюкокортикостероидами (ГКС).
Побочные эффекты системных ГКС — артериальная гипертензия, повышенное возбуждение, аритмия, язвенные кровотечения. Побочные эффекты топических ГКС — осиплость голоса, нарушение микрофлоры с дальнейшим развитием кандидоза слизистых, при применении высоких доз — атрофия кожи, гинекомастия, прибавка массы тела и др. Противопоказания: язвенная болезнь желудка и 12-перстной кишки, тяжелая форма артериальной гипертензии, почечная недостаточность, повышенная чувствительность к глюкокортикоидам в анамнезе.
Симптоматическая терапия.
При развитии бронхоспазма показано ингаляционное введение b2-агонистов и других бронхолитических и противовоспалительных препаратов (беродуала, атровента, вентолина, пульмикорта) через небулайзер. Коррекцию артериальной гипотонии и восполнение объема циркулирующей крови проводят с помощью введения солевых и коллоидных растворов (изотонического раствора хлорида натрия — 500-1000 мл, стабизола — 500 мл, полиглюкина — 400 мл). Применение вазопрессорных аминов (допамина — 400 мг на 500 мл 5%-ной глюкозы, норадреналина — 0,2-2 мл на 500 мл 5%-ного раствора глюкозы, доза титруется до достижения уровня систолического давления 90 мм рт. ст.) возможно только после восполнения ОЦК. При брадикардии допускается введение атропина в дозе 0,3-0,5 мг подкожно (при необходимости инъекцию повторяют каждые 10 мин). При наличии цианоза, диспноэ, сухих хрипов показана также кислородотерапия.
Противошоковые мероприятия (см. рисунок).
При анафилактическом шоке больного следует уложить (голова ниже ног), повернуть голову в сторону (во избежание аспирации рвотных масс), выдвинуть нижнюю челюсть (при наличии съемных зубных протезов их нужно удалить).
Адреналин вводят подкожно в дозе 0,1-0,5 мл 0,1%-ного раствора (препарат выбора), при необходимости инъекции повторяют каждые 20 мин в течение часа под контролем уровня АД. При нестабильной гемодинамике с развитием непосредственной угрозы для жизни возможно внутривенное введение адреналина. При этом 1 мл 0,1%-ного раствора адреналина разводится в 100 мл изотонического раствора хлорида натрия и вводится с начальной скоростью 1 мкг/мин (1 мл в минуту). При необходимости скорость может быть увеличена до 2-10 мкг/мин. Внутривенное введение адреналина проводится под контролем частоты сердечных сокращений, дыхания, уровня артериального давления (систолическое артериальное давление необходимо поддерживать на уровне более 100 мм рт. ст. у взрослых и более 50 мм рт. ст. у детей).
Побочные эффекты адреналина — головокружение, тремор, слабость; сильное сердцебиение, тахикардия, различные аритмии (в том числе желудочковые), появление болей в области сердца; затруднение дыхания; увеличение потливости; чрезмерное повышение артериального давления; задержка мочи у мужчин, страдающих аденомой предстательной железы; повышение уровня сахара в крови у больных сахарным диабетом. Описаны также случаи развития некрозов тканей при повторном подкожном введении адреналина в одно и то же место вследствие местного сужения сосудов. Противопоказания — артериальная гипертензия; выраженный церебральный атеросклероз либо органическое поражение головного мозга; ишемическая болезнь сердца; гипертиреоз; закрытоугольная глаукома; сахарный диабет; гипертрофия предстательной железы; неанафилактический шок; беременность. Однако даже при этих заболеваниях возможно назначение адреналина при анафилактическом шоке по жизненным показаниям и под строгим врачебным контролем.
Типичные ошибки, допускаемые на догоспитальном этапе
Изолированное назначение Н1-гистаминовых блокаторов при тяжелых аллергических реакциях, равно как и при бронхообструктивном синдроме, не имеет самостоятельного значения, и на догоспитальном этапе это лишь приводит к неоправданной потере времени; использование дипразина (пипольфена) опасно усугублением гипотонии. Использование таких препаратов, как глюконат кальция, хлористый кальций, вообще не показано при острых аллергических заболеваниях. Ошибочным следует считать также позднее назначение ГКС, необоснованное применение малых доз ГКС, отказ от использования топических ГКС и b2-агонистов при аллергическом стенозе гортани и бронхоспазме.
Показания к госпитализации
Пациенты с тяжелыми аллергическими заболеваниями должны быть обязательно госпитализированы.
А. Л. Верткин, доктор медицинских наук, профессор А. В. Тополянский, кандидат медицинских наук
Порядок вакцинации пациентов с аллергией на вакцины
Большинство пациентов с предыдущими реакциями на вакцины могут быть безопасно вакцинированы в будущем с соответствующими мерами предосторожности.
Общая стратегия: если внутрикожный тест с вакциной является отрицательным, то вероятностью того, что пациент имеет IgE к любой вакцине является незначительной, и вакцина может быть введена обычным способом. Тем не менее, целесообразно наблюдать за такими пациентами в течение по крайней мере 30 минут и иметь в непосредственной близости укладку для оказания помощи при анафилактическом шоке.
Если кожные пробы вакцины или компонента вакцины положительны, и если вакцина считается необходимой, она все равно может быть введена с использованием протокола градуированных доз (дробное введение по методу Безредко). Успешное введение вакцин пациентам с положительными кожными пробами с использованием дифференцированных протоколов описано для нескольких различных вакцин.
Введение вакцины человеку, страдающему аллергией, даже по такому протоколу дифференцированных доз, по-прежнему сопряжено с риском анафилактической реакции и должно проводиться только после получения письменного информированного согласия. Кроме того, введение следует проводить в условиях наличия персонала и оборудования для распознавания и лечения анафилаксии.
Список литературы
- Johansson SG, Bieber T, Dahl R, et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003 // J Allergy Clin Immunol 2004; 113:832.
- Sampson HA, Muñoz-Furlong A, Campbell RL, et al. Second symposium on the definition and management of anaphylaxis: summary report—Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium // J Allergy Clin Immunol 2006; 117:391.
- Bohlke K, Davis RL, Marcy SM, et al. Risk of anaphylaxis after vaccination of children and adolescents // Pediatrics 2003; 112:815.
- McNeil MM, Weintraub ES, Duffy J, et al. Risk of anaphylaxis after vaccination in children and adults // J Allergy Clin Immunol 2016; 137:868.
- Patja A, Mäkinen-Kiljunen S, Davidkin I, et al. Allergic reactions to measles-mumps-rubella vaccination // Pediatrics 2001; 107:E27.
- Cheng DR, Perrett KP, Choo S, et al. Pediatric anaphylactic adverse events following immunization in Victoria, Australia from 2007 to 2013 // Vaccine 2015; 33:1602.
- National Center for Immunization and Respiratory Diseases. General recommendations on immunization — recommendations of the Advisory Committee on Immunization Practices (ACIP) // MMWR Recomm Rep 2011; 60:1.
- Broder KR, Cortese MM, Iskander JK, et al. Preventing tetanus, diphtheria, and pertussis among adolescents: use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccines recommendations of the Advisory Committee on Immunization Practices (ACIP) // MMWR Recomm Rep 2006; 55:1.
- Kretsinger K, Broder KR, Cortese MM, et al. Preventing tetanus, diphtheria, and pertussis among adults: use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccine recommendations of the Advisory Committee on Immunization Practices (ACIP) and recommendation of ACIP, supported by the Healthcare Infection Control Practices Advisory Committee (HICPAC), for use of Tdap among health-care personnel // MMWR Recomm Rep 2006; 55:1.
- Talbot EA, Brown KH, Kirkland KB, et al. The safety of immunizing with tetanus-diphtheria-acellular pertussis vaccine (Tdap) less than 2 years following previous tetanus vaccination: Experience during a mass vaccination campaign of healthcare personnel during a respiratory illness outbreak // Vaccine 2010; 28:8001.
- Beytout J, Launay O, Guiso N, et al. Safety of Tdap-IPV given one month after Td-IPV booster in healthy young adults: a placebo-controlled trial // Hum Vaccin 2009; 5:315.
- Centers for Disease Control and Prevention (CDC). Updated recommendations for use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis (Tdap) vaccine from the Advisory Committee on Immunization Practices, 2010 // MMWR Morb Mortal Wkly Rep 2011; 60:13.
- Bergfors E, Trollfors B. Sixty-four children with persistent itching nodules and contact allergy to aluminium after vaccination with aluminium-adsorbed vaccines-prognosis and outcome after booster vaccination // Eur J Pediatr 2013; 172:171.
- Kang LW, Crawford N, Tang ML, et al. Hypersensitivity reactions to human papillomavirus vaccine in Australian schoolgirls: retrospective cohort study // BMJ 2008; 337:a2642.
- Kelso JM, Greenhawt MJ. Adverse reactions to vaccines in infectious diseases. In: Middleton’s allergy: Principles and practice, 8th ed, Adkinson NF, Bochner BS, Burks AW, et al (Eds), Elsevier, Philadelphia 2014.
- Centers for Disease Control and Prevention (CDC). Syncope after vaccination—United States, January 2005-July 2007 // MMWR Morb Mortal Wkly Rep 2008; 57:457.
- Kelso JM, Jones RT, Yunginger JW. Anaphylaxis to measles, mumps, and rubella vaccine mediated by IgE to gelatin // J Allergy Clin Immunol 1993; 91:867.
- Sakaguchi M, Nakayama T, Inouye S. Food allergy to gelatin in children with systemic immediate-type reactions, including anaphylaxis, to vaccines // J Allergy Clin Immunol 1996; 98:1058.
- Sakaguchi M, Yamanaka T, Ikeda K, et al. IgE-mediated systemic reactions to gelatin included in the varicella vaccine // J Allergy Clin Immunol 1997; 99:263.
- Sakaguchi M, Miyazawa H, Inouye S. Specific IgE and IgG to gelatin in children with systemic cutaneous reactions to Japanese encephalitis vaccines // Allergy 2001; 56:536.
- Lasley MV. Anaphylaxis after booster influenza vaccine due to gelatin allergy // Pediatr Asthma Allergy Immunol 2007; 20:201.
- Stone CA Jr, Hemler JA, Commins SP, et al. Anaphylaxis after zoster vaccine: Implicating alpha-gal allergy as a possible mechanism // J Allergy Clin Immunol 2017; 139:1710.
- Kumagai T, Yamanaka T, Wataya Y, et al. A strong association between HLA-DR9 and gelatin allergy in the Japanese population // Vaccine 2001; 19:3273.
- Sakaguchi M, Nakayama T, Kaku H, et al. Analysis of HLA in children with gelatin allergy // Tissue Antigens 2002; 59:412.
- Kuno-Sakai H, Kimura M. Removal of gelatin from live vaccines and DTaP-an ultimate solution for vaccine-related gelatin allergy // Biologicals 2003; 31:245.
- O’Brien TC, Maloney CJ, Tauraso NM. Quantitation of residual host protein in chicken embryo-derived vaccines by radial immunodiffusion // Appl Microbiol 1971; 21:780.
- Kelso JM. Raw egg allergy-a potential issue in vaccine allergy // J Allergy Clin Immunol 2000; 106:990.
- Kattan JD, Konstantinou GN, Cox AL, et al. Anaphylaxis to diphtheria, tetanus, and pertussis vaccines among children with cow’s milk allergy // J Allergy Clin Immunol 2011; 128:215.
- Grabenstein JD. Clinical management of hypersensitivities to vaccine components // Hosp Pharm 1997; 32:77.
- Heidary N, Cohen DE. Hypersensitivity reactions to vaccine components // Dermatitis 2005; 16:115.
- Patrizi A, Rizzoli L, Vincenzi C, et al. Sensitization to thimerosal in atopic children // Contact Dermatitis 1999; 40:94.
- Lee-Wong M, Resnick D, Chong K. A generalized reaction to thimerosal from an influenza vaccine // Ann Allergy Asthma Immunol 2005; 94:90.
- Audicana MT, Muñoz D, del Pozo MD, et al. Allergic contact dermatitis from mercury antiseptics and derivatives: study protocol of tolerance to intramuscular injections of thimerosal // Am J Contact Dermat 2002; 13:3.
- Lear JT, English JS. Anaphylaxis after hepatitis B vaccination // Lancet 1995; 345:1249.
- Russell M, Pool V, Kelso JM, Tomazic-Jezic VJ. Vaccination of persons allergic to latex: a review of safety data in the Vaccine Adverse Event Reporting System (VAERS) // Vaccine 2004; 23:664.
- Hamilton RG, Brown RH, Veltri MA, et al. Administering pharmaceuticals to latex-allergic patients from vials containing natural rubber latex closures // Am J Health Syst Pharm 2005; 62:1822.
- DiMiceli L, Pool V, Kelso JM, et al. Vaccination of yeast sensitive individuals: review of safety data in the US vaccine adverse event reporting system (VAERS) // Vaccine 2006; 24:703.
- Zanoni G, Puccetti A, Dolcino M, et al. Dextran-specific IgG response in hypersensitivity reactions to measles-mumps-rubella vaccine // J Allergy Clin Immunol 2008; 122:1233.
- Martín-Muñoz MF, Pereira MJ, Posadas S, et al. Anaphylactic reaction to diphtheria-tetanus vaccine in a child: specific IgE/IgG determinations and cross-reactivity studies // Vaccine 2002; 20:3409.
- Skov PS, Pelck I, Ebbesen F, Poulsen LK. Hypersensitivity to the diphtheria component in the Di-Te-Pol vaccine. A type I allergic reaction demonstrated by basophil histamine release // Pediatr Allergy Immunol 1997; 8:156.
- Bégin P, Vu MQ, Picard M, et al. Spontaneous resolution of diphtheria-tetanus vaccine hypersensitivity in a pediatric population // Allergy 2011; 66:1508.
- Systemic adverse effects of hepatitis B vaccines are rare // Prescrire Int 2004; 13:218.
- Nelson MR, Oaks H, Smith LJ, et al. Anaphylaxis complicating routine childhood immunization: Hemophilus Influenza b conjugated vaccine // Pediatr Asthma Allergy Immunol 2000; 14:315.
- Brotherton JM, Gold MS, Kemp AS, et al. Anaphylaxis following quadrivalent human papillomavirus vaccination // CMAJ 2008; 179:525.
- Nagao M, Fujisawa T, Ihara T, Kino Y. Highly increased levels of IgE antibodies to vaccine components in children with influenza vaccine-associated anaphylaxis // J Allergy Clin Immunol 2016; 137:861.
- Takahashi H, Pool V, Tsai TF, Chen RT. Adverse events after Japanese encephalitis vaccination: review of post-marketing surveillance data from Japan and the United States. The VAERS Working Group // Vaccine 2000; 18:2963.
- James JM, Burks AW, Roberson PK, Sampson HA. Safe administration of the measles vaccine to children allergic to eggs // N Engl J Med 1995; 332:1262.
- Ball R, Braun MM, Mootrey GT, Vaccine Adverse Event Reporting System Working Group. Safety data on meningococcal polysaccharide vaccine from the Vaccine Adverse Event Reporting System // Clin Infect Dis 2001; 32:1273.
- Ponvert C, Ardelean-Jaby D, Colin-Gorski AM, et al. Anaphylaxis to the 23-valent pneumococcal vaccine in child: a case-control study based on immediate responses in skin tests and specific IgE determination // Vaccine 2001; 19:4588.
- Ponvert C, Scheinmann P, de Blic J. Anaphylaxis to the 23-valent pneumococcal vaccine: a second explored case by means of immediate-reading skin tests with pneumococcal vaccines // Vaccine 2010; 28:8256.
- Centers for Disease Control (CDC). Systemic allergic reactions following immunization with human diploid cell rabies vaccine // MMWR Morb Mortal Wkly Rep 1984; 33:185.
- Swanson MC, Rosanoff E, Gurwith M, et al. IgE and IgG antibodies to beta-propiolactone and human serum albumin associated with urticarial reactions to rabies vaccine // J Infect Dis 1987; 155:909.
- Carey AB, Meltzer EO. Diagnosis and «desensitization» in tetanus vaccine hypersensitivity // Ann Allergy 1992; 69:336.
- Mayorga C, Torres MJ, Corzo JL, et al. Immediate allergy to tetanus toxoid vaccine: determination of immunoglobulin E and immunoglobulin G antibodies to allergenic proteins // Ann Allergy Asthma Immunol 2003; 90:238.
- Slater JE, Rabin RL, Martin D. Comments on cow’s milk allergy and diphtheria, tetanus, and pertussis vaccines // J Allergy Clin Immunol 2011; 128:434; author reply 435.
- Begier EM, Burwen DR, Haber P, et al. Postmarketing safety surveillance for typhoid fever vaccines from the Vaccine Adverse Event Reporting System, July 1990 through June 2002 // Clin Infect Dis 2004; 38:771.
- Hoyt RE, Herip DS. Severe systemic reactions attributed to the acetone-inactivated parenteral typhoid vaccine // Mil Med 1996; 161:339.
- Wise RP, Salive ME, Braun MM, et al. Postlicensure safety surveillance for varicella vaccine // JAMA 2000; 284:1271.
- Kelso JM, Mootrey GT, Tsai TF. Anaphylaxis from yellow fever vaccine // J Allergy Clin Immunol 1999; 103:698.
- Tseng HF, Liu A, Sy L, et al. Safety of zoster vaccine in adults from a large managed-care cohort: a Vaccine Safety Datalink study // J Intern Med 2012; 271:510.
- Kelso JM, Greenhawt MJ, Li JT, et al. Adverse reactions to vaccines practice parameter 2012 update // J Allergy Clin Immunol 2012; 130:25.
- Mark A, Björkstén B, Granström M. Immunoglobulin E responses to diphtheria and tetanus toxoids after booster with aluminium-adsorbed and fluid DT-vaccines // Vaccine 1995; 13:669.
- Aalberse RC, van Ree R, Danneman A, Wahn U. IgE antibodies to tetanus toxoid in relation to atopy // Int Arch Allergy Immunol 1995; 107:169.
- Wood RA, Setse R, Halsey N, Clinical Immunization Safety Assessment (CISA) Network Hypersensitivity Working Group. Irritant skin test reactions to common vaccines // J Allergy Clin Immunol 2007; 120:478.
- Bierman CW, Shapiro GG, Pierson WE, et al. Safety of influenza vaccination in allergic children // J Infect Dis 1977; 136 Suppl:S652.
- Miller JR, Orgel HA, Meltzer EO. The safety of egg-containing vaccines for egg-allergic patients // J Allergy Clin Immunol 1983; 71:568.
- Kelso JM, Cockrell GE, Helm RM, Burks AW. Common allergens in avian meats // J Allergy Clin Immunol 1999; 104:202.