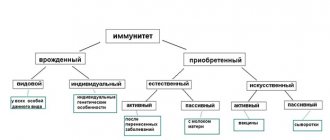
Конструкция ДНК-вакцин
Для получения ДНК-вакцин ген, кодирующий продукцию иммуногенного белка, необходимо встроить в вектор, роль которого выполняют бактериальная плазмида или вирус [4]. Вектор не должен реплицироваться в клетках макроорганизма, поэтому может содержать только прокариотические сайты инициации репликации.
Для создания ДНК-вакцин используются хорошо изученные плазмиды грамотрицательных бактерий (в основном E. coli), в частности многокопийная pUC19 или pBR322 и их производные. Разработаны специальные векторы для ДНК-вакцин — pcDNA3 и pcDNA3.1 (Invitrogen), которые содержат цитомегаловирусный (ЦМВ) промотор и сигнал полиаденилирования гена гормона роста быка. Также к коммерчески доступным плазмидам, которые чаще всего используются в качестве векторов для ДНК-вакцин, относятся: pVAX1 (Invitrogen), pCI, VR1012 DNA, pJW4303, pVAC1-mcs и pVAC2-mcs (InvivoGen). Последние две применяются для усиления гуморального иммунного ответа и содержат антигены к поверхностным структурам мышечных клеток [5].
Из числа вирусных векторов, обеспечивающих более высокий уровень экспрессии целевого антигена, чаще всего используются: дефектный по репликации аденовирус серотипа 5 (AD5), ортопоксвирусы и модифицированные вирусы осповакцины, альфавирусы. Аденовирусный вектор обладает высокой эффективностью трансфекции — до 100 %, в него можно включать до 8 т.п.н. ДНК. Отрицательный момент — синтез собственных белков, способных индуцировать иммунный ответ. Самые используемые осповакцинные модификации — Ankara (MVA) и New York Vaccinia strain (NYVAC). Первая получена в результате 56-кратного пассирования вируса в куриных эмбриональных фибробластах. В геноме NYVAC удалено 18 открытых рамок считывания, ассоциированных с диапазоном хозяев и вирулентностью. В каждый из перечисленных векторов можно встроить до 50 т.п.н. ДНК [6].
Инновационная вакцина от COVID-19 будет доступна к осени
Елена Ковачич, 2 августа 2021, 19:45 — REGNUM «Бетувакс-КоВ-2» — первая в России субъединичная рекомбинантная вакцина. Это означает, что при её создании использовали только искусственно синтезированный определённый фрагмент коронавируса, имеющего ключевое значение для формирования иммунного ответа».
Вакцина
Иван Шилов © ИА REGNUM
Принципиально отличная от других российских вакцин от COVID-19 вакцина разработана Институтом стволовых клеток человека (ИСКЧ). «Бетувакс-Ков-2» выпущена ИСКЧ под патронатом, если так можно сказать, Платформы Национальной технологической инициативы (ПНТИ). Заявка от ПНТИ уже подана в Минздрав РФ.
«Бетувакс-Ков-2», сказано в анонсе ТАСС, «субъединичная рекомбинантная вакцина». Поскольку большинство из нас, хоть и поднаторели в терминах коронавирусной темы, но всё же не врачи или вирусологи, я решила обратиться к разработчикам. Хотелось уточнить детали и задать вопросы о готовящейся к производству после испытаний и выдачи разрешения Минздравом новинке. Пока, как сообщает ТАСС, «по результатам доклинических исследований вакцина показала безопасность и эффективность на моделях животных». Теперь важно понять, как отреагирует на новинку человек.
С просьбой об интервью я обратилась к пресс-секретарю администрации ПАО «Институт стволовых клеток человека» (ИСКЧ) Елене Романовой. достаточно молодая, существует с 2020 года. Естественно, мне было любопытно, как удалось так быстро выпустить инновационный препарат «Бетувакс-КоВ-2», сами-то существуют всего год?!
По словам представителя ИСКЧ, несмотря на столь небольшой отрезок времени — всего год, разработанная «показала хороший профиль безопасности и эффективности с формированием высоких титров нейтрализующих антител против коронавируса SARS-CoV-2 на моделях животных. Перед разработчиками стояла задача создать вакцину, которая потенциально будет нести минимум нежелательных эффектов, которые могут быть связаны с вакцинацией. Такой профиль безопасности сделает вакцину востребованной для людей с различными хроническими заболеваниями, старшей возрастной группы и, возможно, детей».
В чём отличие «Бетувакс-КоВ-2» от других вакцин?
ИСКЧ: «Вакцина «Бетувакс-КоВ-2» является первой в России рекомбинантной вакциной нового поколения на основе сферических частиц из природного материала, имитирующих вирусные частицы, содержащие поверхностный антиген (белок) коронавируса. Данная конструкция вакцины активирует выработку только необходимых защитных антител и клеточного иммунитета, при этом снижая теоретические риски антителозависимого усиления инфекции. Конструкция вакцины «Бетувакс-КоВ-2» также даёт возможность её быстрой оптимизации под новые штаммы коронавируса и многократного её использования. Данная вакцина не несёт в себе генетического материала, избыточной антигенной нагрузки, дополнительных консервантов, стабилизаторов и неорганических адъювантов, что минимизирует риски побочных эффектов».
Пастер наблюдает за подопытными кроликами. Книжная иллюстрация
Лучше ли защита «Бетувакс-КоВ-2» от COVID-19? Если да, почему?
ИСКЧ: «Бетувакс-КоВ-2» — первая в России субъединичная рекомбинантная вакцина. Это означает, что при её создании использовали только искусственно синтезированный определённый фрагмент коронавируса, имеющего ключевое значение для формирования иммунного ответа. Вакцина не содержит цельного вируса (как вакцина с «убитым» вирусом «КовиВак») или других вирусов, использующихся в качестве доставки-вектора (как «Спутник V»). То есть вакцина на такой технологии, как у «Бетувакс-КоВ-2», будет первой в России. Субъединичные вакцины признаны наиболее безопасными на рынке, именно поэтому, например, привычная вакцина от гриппа наиболее распространена именно в формате рекомбинантной субъединичной версии. Данный тип вакцин наименее реактогенный, при их производстве не используется какой-либо вирусный материал, поэтому субъединичные вакцины не приводят к развитию острых воспалительных побочных эффектов, как вакцины других типов — векторные или на основе цельных вирусов».
Клеточные технологии вызывают опасения и споры в смысле возможной провокации онкозаболеваний. Насколько в этом смысле безопасна вакцина для людей?
ИСКЧ: «Доклинические исследования на животных показали безопасность применения вакцины «Бетувакс-КоВ-2» в исследуемых дозах и отсутствие видимых побочных эффектов. Для доказательства полного отсутствия побочных эффектов на людях необходимы клинические испытания».
Как скоро «Бетувакс» будет применяться в широкой практике?
ИСКЧ: «Бетувакс» подал в Минздрав досье для получения разрешения на проведение клинических исследований вакцины. Сейчас ведомство рассматривает заявку и по стандартной процедуре задает разработчикам дополнительные вопросы».
Клетки
Joseph Elsbernd
От себя еще добавлю в качестве пояснения, что специалисты различают три основных подхода к разработке вакцин в зависимости от того, что используют для иммунизации: 1) цельный вирус или бактерия, 2) фрагменты вируса, вызывающие иммунный ответ, 3) только генетический материал, содержащий код для синтеза конкретных белков, а не цельный вирус. Так вот «Бетувакс» как субъединичная вакцина использует фрагменты вируса, с которыми наша иммунная система должна познакомиться. Эти фрагменты не содержат цельных микроорганизмов или безопасных вирусов в качестве вектора. Что, собственно, мы имеем в случае с «КовиВак» и «Спутником». Так что это нечто иное, и будем надеяться, что еще более эффективное. Несмотря на то, что вакцину называют инновацией, ее тип такой же, как у большинства старых вакцин — от коклюша, столбняка, дифтерии и менингита.
Словом, пока кто-то ищет неуязвимых к ковиду или готовится уехать в случае Апокалипсиса в Новую Зеландию, где как бы безопасно в смысле ковида, российские ученые чуть ли не штампуют вакцину за вакциной. А потому есть шанс, что до Апокалипсиса всё же не дойдет. Ведь те пять стран, достаточно небольших, которые названы самыми безопасными в случае фатального исхода пандемии — Новая Зеландия, Исландия, Тасмания, Ирландия и Великобритания — не смогут вместить всех алчущих. Поэтому лучше уж искать способ выживания дома. К тому же мы не миллиардеры Кремниевой долины: они-то и скупают участки и дома в Новой Зеландии. Большинству россиян по причине отсутствия миллиардов никак в заветную пятерку не попасть. Спасаться надо здесь, дома, и сейчас…
Элементы конструктора
Рисунок 3. Конструкция ДНК-вакцины на основе вектора pVAX1 с химерным геном (Rat cDNA, Human cDNA). Pcmv — цитомегаловирусный промотор; MCS — сайт для множественного клонирования генов; BGH pA — терминатор с сигналом полиаденилирования гена гормона роста быка; Kanamycin — ген устойчивости к канамицину; pUC ori — участок начала репликации плазмид группы pUC; HindIII, BstEII, XbaI — сайты рестрикции. Рисунок из [5].
Чтобы пригодиться для создания ДНК-вакцин, каждый уважающий себя вектор должен содержать необходимые конструкционные элементы (рис. 3).
- Структуры, обеспечивающие репликацию плазмиды (используются ori pUC19, pMB1), и сайты рестрикции.
- Селективные маркеры: гены устойчивости к антибиотикам (но не к пенициллину и другим β-лактамным антибиотикам) [5].
- СpG-мотивы бактерий, которые из-за отсутствия метилирования способны усиливать иммунную реакцию. Данный принцип лежит в основе разработки универсальной вакцины и подразумевает использование не генов, кодирующих белки-антигены микробов, а бактериальных последовательностей CG в качестве активного компонента вакцины [7].
- Последовательность Козак — консенсусная последовательность, окружающая старт-кодон (GCC(A/G)CCAUGG), которая играет важную роль в инициации трансляции у эукариот.
- Промотор для экспрессии целевого гена в клетках эукариот. Наиболее часто используют промоторы вируса SV40, цитомегаловируса (часто вместе с интроном А), промотор бета-актина, промоторы, специфичные для определенных видов ткани (например, промотор гена десмина для экспрессии в миоцитах, промотор гена гидроксилазы витамина D3 — в кератиноцитах, альбуминовый — в гепатоцитах). Применение промотора и системы синтеза бактериофага Т7 позволяет осуществлять экспрессию целевого гена без участия транскрипционной системы клеток макроорганизма и, соответственно, без перемещения вектора в ядро [8].
- Целевой ген, кодирующий белок патогена. Он также может содержать дополнительные нуклеотидные последовательности, кодирующие лиганды для рецепторов антигенпредставляющих клеток. Такими последовательностями могут выступать гены маркерного белка CD40, внеклеточного домена Fms-подобной тирозинкиназы-3 или антигена-4 Т-киллеров. Облегчение деградации антигена в протеасоме или лизосоме также будет стимулировать иммунную реакцию. Поэтому для усиления протеолитического расщепления антигена в его последовательность встраивают сигнал убиквитинирования [9, 10].
- После целевого гена следуют сигналы полиаденилирования, например, вируса SV40, гена β-глобина кролика или гормона роста быка.
- Замыкают эту цепочку стоп-кодоны, причем часто используются двойные или тройные терминирующие последовательности (TAGTGATGA).
Службы доставки
Способам введения ДНК-вакцин в организм уделяется не меньше внимания, чем созданию самих конструкций, так как от этого зависит успех иммунизации в целом. Поэтому разработаны различные, порой весьма хитроумные, методы доставки таких вакцин в организм.
Рисунок 4. Одноразовый генный пистолет компании PowderJect. а — внешний вид; б — в разрезе. Рисунок с сайта www.apteka.ua.
Самый простой — это парентеральный способ введения, который заключается в инъекции ДНК-вакцин в солевом растворе (внутримышечно, внутрикожно). При этом бόльшая часть ДНК поступает в межклеточное пространство и только потом включается в клетки.
Использование генного пистолета. Для этого ДНК фиксируют на микроскопических золотых гранулах (около 1–2 мкм), а затем с помощью устройства, приводимого в действие сжатым гелием, гранулы «выстреливают» непосредственно внутрь клеток (рис. 4). Для данного способа доставки требуется значительно меньшее количество вводимого материала, чем для внутримышечной инъекции. Так, для инъекции мышам нужно 10-100 мкг препарата, а с использованием генного пистолета достаточно 0,1-1 мкг.
Электропорация — техника, которая с использованием электрических импульсов позволяет формировать поры в клеточной мембране и доставлять ДНК непосредственно в клетки.
Микроконтейнеры из полиматериалов. Московские ученые, например, создали пористую микросферу из карбоната кальция, покрытую несколькими слоями полисахаридов, в которую упаковывается молекула ДНК. Если микросферы в полимерной оболочке поместить в подкисленный раствор, карбонат кальция внутри растворится и уйдет через полимерную мембрану. Внутри останется только ДНК, подлежащая транспортировке. Подобных микроконтейнеров для доставки ДНК разработано не так много. Есть зарубежные аналоги, в которых оболочка капсулы выполнена из полимолочной кислоты. На их основе создают вакцины против гепатита и даже СПИДа. Средний диаметр микрокапсул для доставки ДНК-вакцин всего 1–2 микрона. Такие микрокапсулы можно ввести подкожно или даже в кровь. Если в микрочастицу вместе с ДНК или лекарством поместить фермент, расщепляющий оболочку капсулы изнутри, то высвобождением лекарства можно управлять: чем меньше фермента, тем медленнее рушится оболочка.
Липосомные носители обеспечивают высокую эффективность доставки при внутривенном введении, при этом экспрессия целевых генов значительно возрастает, так как осуществляется во многих органах, и особенно в селезенке.
ДНК-вакцины можно вводить перорально с использованием бактериальных носителей. Для этих целей применяются, например, модифицированные бактерии Shigella flexneri с делецией в гене asd. Мутантные бактерии растут in vitro на среде с диаминопимелиновой кислотой и, проникая в эукариотические клетки, не размножаются в них, так как отсутствует упомянутая кислота, а продуцируют закодированные в плазмиде антигены [6]. Для перорального введения создан вектор на основе ослабленного штамма Salmonella, который способен к самоуничтожению в организме через определенный период времени после выполнения иммунизационных задач. Для этого бактерию модифицировали таким образом, что ее выживание стало зависеть от наличия искусственных сахаров, не встречающихся в условиях организма. После того как в клетках, зараженных генно-инженерным штаммом Salmonella, заканчивается запас специфического сахара, поставляемого вместе с вакциной, бактерии не способны сохранить целостность своих клеточных стенок, что приводит к их гибели [11].
Была предложена оригинальная система доставки ДНК с помощью «теней» — неживых клеток грамотрицательных бактерий, лишенных цитоплазматического содержимого, но сохраняющих морфологию и антигенные структуры, включая адгезивные факторы. «Тени» обладают тропностью к антигенпрезентирующим клеткам макроорганизма и адъювантными свойствами, усиливающими иммунный ответ. Кроме того, в лиофильно-высушенном состоянии препараты «теней» хранятся при комнатной температуре неопределенно долгое время, а их производство дешево [6].
Разработана технология доставки ДНК-вакцин с использованием бактериофагов [12]. В данном случае вакцинная ДНК встраивается в геном вектора-бактериофага, которым затем иммунизируют макроорганизм [13].
Нужно учитывать, что разные методы доставки ДНК-вакцин в организм обеспечивают развитие различных клеточных реакций, при этом важные иммунологические пути могут быть стимулированы или, наоборот, не задействованы в ходе развития защитного ответа. Способы и места введения ДНК-вакцин варьируют для разных видов организмов. Например, уши свиньи — отличное место для инъекций, а вот введение препарата в уши овец или коров неэффективно.
Инструкция по применению вакцины «Спутник V»: механизм действия и как должна проходить прививка
Рассказываем историю создания, механизм действия, полное название вакцины «Спутник V» от коронавируса центра Гамалеи, что говорится в инструкции по применению препарата, а также как должна проходить прививка.
«Спутник V» — первая зарегистрированная в России вакцина от коронавируса. Её регистрационное наименование — «Гам-КОВИД-ВАК» (лат. Gam-COVID-Vak). Препарат разработали в НИЦЭМ им. Н.Ф. Гамалеи.
История вакцины
Название «Спутник V» выбрано не случайно. Как сообщается на сайте препарата, его назвали в честь первого советского космического спутника. А буква V (не римская пять, как заблуждаются многие) от слова victory — «победа».
Во время разработки препарата центр Гамалеи использовал в работе платформу, на которой был создан ряд других вакцин, в том числе от лихорадки Эбола. Отмечается, что саму платформу разработали около 25 лет назад. Её планировали использовать для генной терапии.
Первые добровольцы получили прививку уже 30 марта 2021 года. Тогда прошло только 19 дней с объявления ВОЗ о пандемии коронавируса. Ещё спустя три недели добровольцы сделали второй укол. По данным на август 2021 года, все участники испытаний имели хороший иммунитет. Серьёзных побочных эффектов у них зафиксировано не было.
Как работает вакцина
Препарат состоит из двух растворов, которые содержат рекомбинантные аденовирусы человека Ad5 и Ad26. Они используются как “транспорт” (или вектор) для доставки гена, который кодирует S-белок коронавируса SARC-CoV-2.
Два укола нужно не просто так: во время первой вакцинации вектор попадает в клетку, а организм начинает синтезировать S-белок коронавируса. Это вызывает ответную реакцию — выработку иммунитета. Спустя 21 день происходит повторная вакцинация другим вектором, который ещё сильнее «подстёгивает» иммунный ответ, позволяя формировать более длительный иммунитет против инфекции.
Как должна проходить прививка
Вакцину вводят внутримышечно людям старше 18 лет. Перед уколом врач должен измерить давление, температуру тела и проверить сатурацию крови. В противопоказаниях препарата указаны гиперчувствительность к его компонентам, тяжёлые аллергические реакции, обострение инфекционных и неинфекционных заболеваний, беременность и период грудного вскармливания.
В случае обострения хронических инфекционных и неинфекционных заболеваний препарат вводят спустя 2-4 недели после выздоровления или ремиссии.
После вакцинации на месте укола могут появиться покраснение и возникнуть неприятные ощущения. Однако в большинстве случаев, это быстро проходит. Кроме того, побочным эффектом от прививки может быть повышение температуры. В этой ситуации тоже волноваться не стоит. К врачу необходимо обращаться, если температура держится несколько дней.
Уважаемые читатели Царьграда!
Если вам есть чем поделиться с редакцией Царьград Санкт-Петербург, присылайте свои наблюдения, вопросы и новости на нашу страничку в «Вконтакте» или на электронную почту
А также присоединяйтесь к нам в «Яндекс.Дзен».
Помощники генетических вакцин
Для усиления иммунного ответа, вызванного ДНК-вакцинами, совместно с ними вводят различные адъюванты, например, плазмиды, кодирующие синтез цитокинов, гранулоцитарно-макрофагального колониестимулирующего фактора и других костимуляторных молекул (B7.1 (CD80), B7.2 (CD86) и CD40) [14].
Для ДНК-вакцины против ВИЧ создана конструкция, которая обеспечивает получение более высокого титра антител и его сохранность в течение более длительного времени по сравнению с обычной ДНК-вакциной. Эта молекулярная вирусоподобная конструкция представляет собой частицы диаметром 25-30 нм, содержащие в центре полинуклеотидный комплекс — рекомбинантную плазмиду pGEX-2T-TBI с генами инфекционного агента ВИЧ-1 или двухцепочечную РНК, которая является стимулятором неспецифической резистентности организма. На поверхности конструкции располагаются гибридные белки, содержащие эпитопы ВИЧ-1 и фермент (например, глутатион-S-трансферазу или галактозидазу). Связь между полинуклеотидным комплексом и гибридными белками осуществляется посредством конъюгата: спермидин (для связи конъюгата с полинуклеотидным комплексом) — полиглюкин — субстрат для фермента (например, глутатион или галактопиранозид; для аффинной сорбции гибридных белков на конструкцию).
Современное состояние ДНК-вакцинологии
В настоящее время в разработке находится около 420 ДНК-вакцин против заболеваний различной этиологии как человека, так и животных.
Бόльшая часть разрабатываемых противоинфекционных терапевтических ДНК-вакцин нацелена на ВИЧ-1. Существенные успехи достигнуты в активной иммунизации против вируса папилломы человека. Некоторые вакцины находятся на стадии клинических испытаний и, возможно, в скором времени будут введены в обязательную практику. Так, американская компания Inovio, специализирующаяся на разработке ДНК-вакцин, создала препарат против цервикальной дисплазии VGX-3100, который проходит вторую фазу клинических испытаний. В 2013 г. VGX-3100 удостоилась награды «Лучшая терапевтическая вакцина» на Всемирном конгрессе по вакцинам. В I или IIа фазах клинических испытаний находятся: вакцины против гепатита С, цервикального рака, рака головы и шеи, СПИДа, гриппа. Компанией Inovio также ведется активная разработка вакцин против лихорадки Эбола* и рака простаты.
* — О более привычном, но не менее перспективном методе борьбы с вирусом Эбола — с помощью «коктейля» из моноклональных антител — читайте в статье «Вирус Эбола и макак-резус: получено новое эффективное лекарство» [15]. — Ред.
Разработке способов вакцинотерапии онкологических заболеваний при помощи рекомбинантных ДНК большое внимание уделяют и другие организации. Хорошую эффективность показала ДНК-вакцина против лейкемии, созданная в Саутгемптонском университете (но вводимая с помощью электропоратора всё той же Inovio). Вакцина направлена на подавление в организме активности гена WT1 (Wilms tumor gene). Именно повышенная активность этого гена отмечается в опухолевых клетках различных видов. В ходе I фазы клинических испытаний у пациентов наблюдалось развитие иммунного ответа, в том числе активация Т-киллеров и выработка антител; была также доказана безопасность новой вакцины. Испытания перешли в фазу II, однако из-за проблем с финансированием организаторы пока не могут увеличить число участников [16].
Животные нуждаются в такой же защите, как и люди. В связи с этим для ветеринарии разрабатываются ДНК-вакцины против бычьего и лошадиного герпесвирусов, собачьего вируса чумы, вируса классической свиной лихорадки, кроличьей папилломы, ящура, вируса инфекционного гемопоэтического некроза, вируса гриппа, вируса японского энцефалита, вируса бешенства, вируса везикулярного стоматита и т.д. [13]. Много ДНК-вакцин создается для борьбы с вирусными, бактериальными и эукариотическими патогенами рыб [17].
Активно разрабатываются ДНК-вакцины для повышения иммунитета птиц. Многокомпонентные ДНК-вакцины могут сократить количество прививок, необходимых во время короткой жизни птиц и позволят избежать риска увеличения вирулентности некоторых патогенов. В случае птицеводства проблема связана с тем, что вакцины вводятся в амниотическую жидкость яиц, которая обладает ДНКазной активностью, поэтому свойства ДНК-вакцины могут ухудшиться. Заключение ДНК в катионные липосомы, скорее всего, поможет решить эту проблему.
Из множества разработанных ДНК-вакцин на сегодняшний день лицензировано всего несколько, причем повезло в этом плане только животным (табл. 1).
Таблица 1. Лицензированные ДНК-вакцины [18].
| Торговое название вакцины | Год лицензирования | Мишень | Животное | Продукт вакцины | Цель создания вакцины |
| «Вэст Найл-Инноватор» (США) | 2005 | Вирус лихорадки Западного Нила | Лошади | Структурный белок вируса PreM-E | Защита против вируса |
| «Апекс-ай-эйч-эн» (Канада) Apex-IHN | 2005 | Возбудитель инфекционного некроза гемопоэтической ткани (ИНГТ) | Рыбы семейства лососевые | Вирусный гликопротеин | Повышение количества и качества рыбной продукции |
| «ЛайфТайд Эс-Даблъю 5» (Австралия) LifeTide® SW 5 | 2008 | Гормон роста | Свиньи и другой домашний скот | Соматолиберин свиньи | Увеличение выводка у свиноматок; значительно уменьшает перинатальную смертность и заболеваемость |
| «Онцепт» (США) | 2006 | Меланома | Собаки | Тирозиназа человека | Как альтернатива лучевой терапии и операционному вмешательству при лечении меланомы |
| PsaA ДНК вакцины (Бразилия) | 2001 | Пневмония | Исследована на мышах | Поверхностный адгезин А пневмококка | Борьба со Streptococcus pneumoniae |
| West Nile Virus DNA Vaccine (США) USDA: 1995.D0 | Вирус лихорадки Западного Нила | Сейвал (сайдяной, или ивасёвый кит) | Структурный белок вируса | Защита от вируса |
Данные вакцины, одобренные Управлением по контролю над продуктами питания и лекарственными препаратами США (FDA), созданы на основе плазмид. Для первых трех из них рекомендованный производителем способ введения — внутримышечно, для вакцины «ЛайфТайд» — внутримышечная инъекция, совмещенная с электропорацией. Если остальные вакцины направлены на активацию иммунитета, то для препарата «ЛайфТайд» иммуностимулирующее действие является дополнительным. Продукт вакцины — соматолиберин — стимулирует высвобождение гипофизом гормона роста и пролактина. Их действие у свиней приводит к росту массы животных и увеличению численности выводка. Вместе с тем, введение плазмиды, которая кодирует соматолиберин, стимулирует выработку Т-лимфоцитов и естественных киллеров, следовательно, увеличивает иммунную сопротивляемость организма.
Процедура внедрения препаратов в ветеринарную практику проще, чем в клиническую человеческую, поэтому некоторые ДНК-вакцины уже применяются для иммунизации животных.
Рутинно используются вакцины для оральной иммунизации лисиц против бешенства. Рекомбинантные вакцины V-RG (Vaccinia Rabies Glyсoprotein — оспенный гликопротеин вируса бешенства) созданы путем введения в геном вируса оспы последовательности ДНК, кодирующей гликопротеин вируса бешенства. Вакцинация лисиц была начата в 2007 году, а к 2009 г. заболеваемость сократилась на 85% [19].
Созданы противоопухолевые препараты, которые продемонстрировали высокую эффективность на животных и применяются в ветеринарной практике. Для лечения меланомы у собак в ветеринарии США с 2007 года используется ДНК-вакцина «Онцепт» (рис. 5). Как показала практика, этот препарат излечивает от меланомы или существенно продлевает больным собакам жизнь [20].
Рисунок 5. Препарат ДНК-вакцины против меланомы собак. Рисунок из [20].
Более новый препарат «Еленаген» (Elenagen) был разработан международным консорциумом под руководством компании CureLab Oncology (США). Хотя «Еленаген» является новым препаратом, с ним уже были проведены обширные исследования на различных опухолях мышей и крыс. Эти исследования с использованием сотен животных показали, что препарат подавляет рост саркомы, рака молочной железы, карциномы легких и меланомы, т.е. быстрорастущих и очень агрессивных опухолей. «Еленаген» не продемонстрировал токсического побочного действия. Более того, препарат оказался эффективным и в случае лимфосаркомы собак. В настоящее время начато исследование спектра противоопухолевого действия «Еленагена» у собак и кошек. В отличие от «Онцепта», который эффективен только при меланоме, вакцина «Еленаген» подавляет рост как меланомы, так и других злокачественных опухолей. За счет более разнопланового механизма действия новый препарат может оказывать дополнительное оздоровляющее и укрепляющее влияние на организм животного.
* * *
Таким образом, с помощью ДНК-вакцин можно сформировать устойчивый иммунитет против инфекционных агентов различной природы. Их разработкой уже более 20 лет занимаются в различных лабораториях мира, но, несмотря на это, такие вакцины практически не используются в клинической практике. Это связано с тем, что пока нет ответов на ряд вопросов, касающихся в первую очередь безопасности ДНК-вакцин. Хотя имеющиеся данные не дают оснований для особенного волнения: эти препараты не опаснее многих факторов, воздействию которых человек сознательно подвергает себя ежедневно. ДНК-вакцины вполне могут оказаться чудесным открытием, которое спасет многие жизни.
Виды вакцин
В состав вакцин входят действующие вещества, или иммуногены, и вспомогательные вещества. Иммуногены отвечают за активизацию иммунитета. Вспомогательные вещества применяются для создания вакцин с оптимальным качественным составом, для повышения их эффективности, увеличения срока хранения.
Выделяют различные виды вакцин.
Живые вакцины
Живые вакцины производят из живых микроорганизмов с пониженной вирулентностью. Большинство таких вакцин способствуют выработке длительно сохраняющегося на высоком уровне иммунитета. Живыми являются вакцины против гриппа, кори , эпидемического паротита, желтой лихорадки и др.
Инактивированные (убитые) вакцины
Инактивированные (убитые) вакцины получают путем полного обезвреживания бактерий и вирусов с сохранением их иммуногенных свойств. Различают цельноклеточные, субъединичные, рекомбинантные вакцины и сплит-вакцины.
Цельноклеточные (цельновирионные) вакцины
Цельноклеточные (цельновирионные) вакцины приготовляют путем лиофилизированного высушивания (при низкой температуре в условиях вакуума), нагревания или обработки химическими веществами (формалином, формальдегидом). К ним относятся вакцины против коклюша (АКДС), гриппа, вирусного гепатита А, клещевого энцефалита, холеры, идр.
Субъединичные вакцины
Субъединичные вакцины содержат только поверхностные антигены, что позволяет уменьшить в вакцине содержание белка и, следовательно, снизить ее аллергенность. К субъединичным вакцинам относятся вакцины против гриппа, пневмококковой, менингококковой, гемофильной инфекций, и др. Сплит-вакцины Сплит-вакцины изготавливают из разрушенных вирусов. Они содержат фрагментированные и очищенные частицы, в том числе поверхностные белки и другие компоненты вирусов. В эту группу входят вакцины против гриппа и др.
Рекомбинантные вакцины
Рекомбинантные вакцины относятся к новому поколению иммунных препаратов, произведенных посредством встраивания антигена вируса в геном дрожжевых клеток. Представителем данной группы является вакцина против вирусного гепатита В.
Анатоксины
Анатоксины изготавливают из экзотоксинов (токсинов, выделяемых возбудителями). Они легко дозируются и комбинируются с другими вакцинами. При введении анатоксинов вырабатывается антитоксигеский иммунитет. Используют дифтерийный, столбнячный, стафилококковый анатоксины, а также анатоксины против ботулизма и газовой гангрены.
Различают моновакцины
(содержащие один антиген), ассоциированные, или комбинированные (имеющие несколько антигенов), и поливалентные вакцины (состоящие из различных штаммов одного вида микроорганизмов). Вспомогательные вещества К вспомогательным веществам вакцин относятся адсорбенты, консерванты, эмульгаторы, индикаторы рН, стабилизаторы.
Адсорбенты
(адъюванты) — нерастворимые соли алюминия (фосфат или гидроокись), усиливающие действие вакцины и, следовательно, значительно увеличивающие силу иммунного ответа. Иногда в качестве адсорбентов используются транспортные белки (они входят в состав дифтерийного, столбнячного анатоксинов). Консерванты нужны для подавления размножения «посторонних» микроорганизмов. Для этой цели используют тиомерсал (мертиолят), формальдегид, феноксиэтанол, фенол и антибиотики (неомицин, гентамицин, полимиксин). Содержание консервантов в вакцинах крайне низкое, и в таких концентрациях они не представляют какой-либо опасности. Небольшие количества эмульгаторов добавляют для улучшения растворения сухих вакцин. При производстве многих сухих вакцин в качестве стабилизаторов используют декстран, сахарозу, сорбит, желатин, альбумин. В качестве индикатора рН часто используют метиловый красный. Можно сразу обнаружить «сдвиг» показателя кислотности по изменению цвета препарата и забраковать вакцину.
Источник: www.microgen.ru
Новость размещена сайтом:
Литература
- Вакцины в вопросах и ответах;
- Википедия: «ДНК-вакцина»;
- Зверев В.В. (2006). Вакцинопрофилактика: прошлое, настоящее, будущее. Вестник биотехнологии. 2, 58–62;
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- Montgomery D.L., Prather K.J. (2006). Design of plasmid DNA constructs for vaccines. Methods Mol. Med. 127, 11–22;
- Попов Ю.А., Микшис Н.И. (2010). Генетические (ДНК) вакцины. Проблемы особо опасных инфекций. 105, 20–24;
- Олишевский С.В., Козак В.В., Яниш Ю.В., Рыбалко С.Л., Шляховенко В.А. (2006). Иммуностимулирующая CpG-ДНК: перспективы клинического применения в онкологии. Онкология. 8, 209–217;
- Donnelly J.J., Ulmer J.B. (1999). DNA vaccines for viral diseases. Braz. J. Med. Biol. Res. 32, 215–222;
- Стародубова Е.С., Исагулянц М.Г., Карпов В.Л. (2010). Регуляция процессинга иммуногена: сигнальные последовательности и их использование для создания нового поколения ДНК-вакцин. Acta Naturae. 2, 59–65.;
- Вездесущий убиквитин;
- Kong W., Brovolda M., Koeneman B.A., Clark-Curtiss J., Curtiss III R. (2012). Turning self-destructing Salmonella into a universal DNA vaccine delivery platform. PNAS. 47, 19414–19419;
- Вирусы-платформы: яд во благо;
- Mateen I., Irshad S. (2011). A review on DNA vaccines. J. Health Sci. 1, 1–7;
- «Мусорная» ДНК управляет эволюцией млекопитающих?;
- Вирус Эбола и макака резус: получено новое эффективное лекарство;
- DNA vaccine for leukemia. Сайт компании Inovio Pharmaceuticals;
- Kurath G. (2008). Biotechnology and DNA vaccines for aquatic animals. Rev. Sci. Tech. 27, 175–196;
- DNAVaxDB: DNA Vaccine (электронная база данных ДНК-вакцин);
- Горбачева П., Макаров В.В. (2010). Рекомбинантная антирабическая вакцина для оральной иммунизации лисиц. Ветеринарная патология. 2, 16–18;
- ONCEPT® Web Site (сайт препарата Oncept, Merial Ltd)..