Главная — Для населения
- Карта медицинских организаций
- Вакцинация
- Диспансеризация
- Флюорография
- Адреса и время работы поликлиник
- Травмпункты
- Онкология
- Где сдать тест на ВИЧ
- Кабинет здорового ребенка
- Услуги
- Профилактика ССЗ
- Профилактика заболеваний
- Всемирный день безопасности пациентов
- Газета «Медицинские вести»
- специалисту
- Школа Здоровья
— Все о вакцинации
- Обращение к родителям
- График работы прививочных кабинетов Екатеринбург
- График работы прививочных кабинетов Свердловской области
- Прививки: Хочу все знать
- Вакцинация ребенка
- Региональный календарь прививок для взрослых
— Прививки: Хочу все знать — Как прививка помогает сформировать иммунитет?
Каждую секунду человек сталкивается с сотнями бактерий и вирусов, которые могут привести к тому или иному заболеванию. Кроме того, в организме постоянно возникают атипичные клетки, дальнейшее размножение которых становится причиной злокачественных образований. Иммунитет — механизм защиты. Он предохраняет от бактерий, вирусов, распознает чужие, опухолевые клетки.
Иммунная система представлена такими органами, как: лимфатические узлы, селезенка, тимус и специальные клетки крови. Она выполняет следующие задачи:
- распознает бактерию или вирус, попавший в организм;
- начинает синтез белков-антител;
- запоминает возбудителя, чтобы «дать ему отпор» в будущем.
Важную роль в защите играют элементы крови: фагоциты, T- и B-лимфоциты. Каждая группа клеток выполняет свою работу.
Фагоциты — первые клетки, которые оказываются в очаге инфекции. Они захватывают, поглощают и переваривают чужеродных агентов. Они справляются только с достаточно «слабыми» агрессорами, визит которых проходит для человека без каких-либо симптомов.
Переваривая «чужаков» фагоциты выделяют вещества-цитокины, которые привлекают в очаг более серьезную артиллерию — клетки-лимфоциты. Существует 2 основные группы лимфоцитов.
B-лимфоциты синтезируют 5 групп белков-иммуноглобулинов. Для защиты от конкретной инфекции имеют значение типы M и G. Иммуноглобулины сохраняются в организме и в течение длительного времени защищают человека от повторных случаев заболевания. Вакцинация использует иммунную память: человеку вводят антигены или ослабленных возбудителей инфекции. При повторной атаке механизм защиты включается немедленно.
T-лимфоциты выполняют различные задачи: одна группа помогает B-лимфоцитам синтезировать антитела, вторая — уничтожает больные или атипичные клетки самого организма, а третья усиливает или ослабляет иммунный ответ.
Что такое активный и пассивный иммунитет
Человек может получать антитела различными путями. Пассивно антитела поступают в организм через плаценту во время беременности, с молоком матери после рождения или при экстренной иммунизации готовыми иммуноглобулинами. Такой иммунитет нестоек и нуждается в скором «обновлении»: антитела защищают лишь тогда, пока циркулируют в кровотоке. Самостоятельно они не воспроизводятся.
Активный иммунитет возникает после перенесенного инфекционного заболевания или вакцинации, так как попадание в организм самого возбудителя или его фрагментов запускает образование новых колоний B-лимфоцитов. Эти клетки быстро синтезируют антитела и защищают организм. Так человек или не заболевает, или переносит инфекцию легко.
Длительность активной защиты зависит от вида возбудителя, поэтому некоторые болезни человек может перенести лишь однократно, другие возникают повторно. Это же утверждение справедливо и для прививок: одни вакцины вводят 1-2 раза в течение всей жизни (например, прививка от кори, краснухи), а другие требуют ревакцинации через определенный срок (например, дифтерия, столбняк – каждые 10 лет).
БИОЛОГИЧЕСКИЙ ОТДЕЛ ЦЕНТРА ПЕДАГОГИЧЕСКОГО МАСТЕРСТВА
Автор статьи Зыбина А.М.
Благодаря наличию иммунной системы организм защищен от большинства болезнетворных организмов (вирусов, бактерий, грибков, простейших, гельминтов и т. д.) и токсических продуктов их жизнедеятельности. Таким образом, иммунитет направлен на защиту организма, поддержание его целостности и индивидуальности.
Иммунитет можно разделить на клеточный и гуморальный. Клеточный иммунитет обеспечивается лейкоцитами при прямом их контакте с патогеном (фагоцитоз, повреждение патогена и т. д.). Гуморальный иммунитет обеспечивают белковые факторы, вырабатываемые клетками. К ним относят антитела и систему комплемента.
Рис. 1. Виды иммунитета.
По функциям иммунитет делят на врожденный и приобретенный. Врожденный иммунитет включает особенности индивидуума или вида, которые обеспечивают защиту от патогенов. Для проникновения вирусов и бактерий в организм и в клетки, необходимо наличие специальных белков на мембране. Такие белки чаще всего видоспецифичны, поэтому большинство болезней, от которых страдают животные, человеку не страшны. Даже внутри одного вида, существуют индивидуальные отличия белков, которые могут сделать часть популяции невосприимчивой к заболеванию.
Приобретенный активный иммунитет возникает при контакте с патогеном и последующей выработке антител. Он может произойти естественным путем (болезнь) искусственным (вакцина). В любом случае остаются клетки памяти и повторный контакт с патогеном уже не будет вызывать болезнь. Также антитела можно получить пассивно: с молоком матери или в виде сыворотки. Они защищают организм до тех пор, пока циркулируют в крови. Клетки памяти при этом не сохраняются и при повторном контакте с патогеном возможно заражение.
Иммунитет обеспечивают белые кровяные тельца – лейкоциты. Все они образуются в красном костном мозге. Лейкоциты принято делить на гранулоциты и агранулоциты.
К гранулоцитам относят нейтрофилы, базофилы и эозинофилы. Все они содержат большое количество гранул в цитоплазме, в которых запасены вещества, необходимые для борьбы с патогенами. Название гранулоцитов связано с красителями, которыми окрашиваются гранулы (гематоксилин – основный, эозин — кислый). Кроме того, они способны к фагоцитозу небольших частиц.
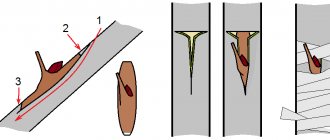
Нейтрофилы (рис. 2 а, г) составляют 93-96% всех лейкоцитов крови. Они имеют сегментированное (3-5 сегмента) ядро и окрашиваются и гематоксилином, и эозином. Они способны как к фагоцитозу небольших частиц, так и к образованию активных форм кислорода. Нейтрофилы могут жить и бороться с патогенами даже в анаэробных условиях. Они локализуются в крови и очагах воспаления, участвуют в образовании гноя. Эффективны против грибка, бактерий и протистов.
Эозинофилы (рис. 2 б, д) имеют сегментированное ядро (2 сегмента) и окрашиваются эозином. Они обеспечивают противогельминтный иммунитет (выделяют токсичные вещества и активные формы кислорода из гранул рядом с паразитом). Также они эффективно защищают организм от простейших. Способны к рециркуляции, то есть возвращению в кровь из тканей.
Рис. 2. Фотографии (а-в) и схематичное строение (г-е) нейтрофила (а, г), эозинофила (б, д) и базофила (в, е).
Базофилы (рис. 2 в, е) составляют 0,5-1% лейкоцитов крови. Они имеют S-образное ядро и их цитоплазма плотно набита гранулами, которые окрашиваются гематоксилином и содержат много гепарина и гистамина. Базофилы способны встраивать в мембрану IgE, благодаря этому специфически связываться и атаковать патоген. Все эти признаки характерны и для тучных клеток, из-за чего ранее базофилы считались их предшественниками. Однако, в настоящее время установлено, что тучные клетки имеют иное происхождение. Базофилы участвуют в реализации противогельминтного ответа. Они выделяют медиаторы воспаления и увеличивают проницаемость сосудов, что дополнительно привлекает другие иммунные клетки. Участвуют в аллергических реакциях немедленного типа.
Агранулоциты делятся на моноциты и лимфоциты.
Рис. 3. Фотография (а) и схематичное строение (б) моноцитов.
Моноциты (рис. 3) самые активные лейкоциты крови. Имеют клетку с крупным бобовидным ядром. Переходя в ткани, превращаются в макрофагов — профессиональных фагоцитов. Макрофаги способны поглощать даже очень крупные частицы. Мембрана этих клеток содержит Toll-подобные рецепторы, позволяющие распознавать и уничтожать консервативные структуры мембраны и клеточной стенки микроорганизмов. Если же макрофаги не способны поглотить чужеродную частицу, они облепляют ее со всех сторон и сливаются, изолируя частицу от организма. Макрофаги поглощают не только патогены, но и остатки мертвых клеток организма. Кроме того, они являются антиген-презентирующими клетками.
Лимфоциты имеют разнообразные функции. Выделяют T- и В-лимфоциты. Оба типа лимфоцитов образуются в красном костном мозге. Однако, их созревание проходит в разных местах: Т-лимфоцитов в тимусе, В-лимфоцитов – в красном костном мозге. Т-лимфоциты подразделяют на Т-киллеров, Т-хелперов. Также к лимфоцитам относят натуральных (естественных) киллеров. Как и все иммунные клетки, они образуются в красном костном мозге, однако, место их созревания до сих пор находится под вопросом. Созревание лимфоцитов проходит в детском возрасте, после чего все лимфоциты преимущественно локализуются в лимфатических узлах и в селезенке.
В-лимфоциты обеспечивают гуморальный приобретенный иммунитет и являются источником антител нашего организма. Антитела (иммуноглобулины, Ig) — белковые соединения плазмы крови (γ-глобулины), образующиеся в ответ на введение в организм человека бактерий, вирусов, белковых токсинов и других антигенов. Связываясь активными участками (центрами) с бактериями или вирусами, антитела препятствуют их размножению или нейтрализуют выделяемые ими токсические вещества. Кроме того, антитела являются своеобразной «меткой» для иммунных клеток о том, что частицу, к которой они присоединились, необходимо поглотить. При этом антитела распознают только чужеродные организму макромолекулы.
Антитела состоят из двух идентичных тяжёлых цепей (H-цепи) и из двух идентичных лёгких цепей (L-цепей) (рис. 4а). К тяжёлым цепям ковалентно присоединены олигосахариды. Каждая цепь имеет конститутивные (Fc) и вариабельные (Fab) фрагменты.
Конститутивный фрагмент консервативен и необходим для взаимодействия антитела с иммунными клетками. Базофилы и тучные клетки встраивают готовые антитела в мембрану и используют их как рецептор, что позволяет им быстро и бурно реагировать на патоген при его связывании мембранным антителом. В-лимфоциты встраивают в собственную мембрану антитела, той специфичности, которую производят сами. При связывании патогена с мембранным иммуноглобулином, становится возможна активация В-лимфоцита. При присоединении свободных (не встроенных в мембрану) антител к патогену, макрофаги и другие иммунные клетки могут провзаимодействовать с конститутивным фрагментом антитела. Это послужит сигналом к уничтожению помеченной молекулы или организма.
Вариабельный фрагмент антитела индивидуален для каждого В-лимфоцита. Именно этот участок (идиотоп) связывается с патогеном. Причем антитела разных В-лимфоцитов могут присоединяться к различным участкам одного и того же патогена, антитела одного В-лимфоцита связывают всегда один участок (эпитоп) (рис. 4 б). Благодаря вариабельности этих фрагментов, в организме одного человека может существовать до 108 вариантов антител.
Поскольку образование Fab фрагмента носит случайный характер у каждого В-лимфоцита, в период созревания в красном костном мозге они проходят селекцию. Как уже упоминалось ранее, эти клетки встраивают иммуноглобулины в мембрану и используют как рецептор. B-клетки, иммуноглобулиновые рецепторы которых способны взаимодействовать с собственными антигенами, либо погибают в результате апоптоза, либо приходят в состояние ареактивности (анергии). Таким образом, сохраняют активность только клетки, которые не реагируют на собственные антигены.
Рис. 4. Строение антитела (а) и его связывание с различными эпитопами антигена (б).
Тем не менее для активации зрелого В-лимфоцита одного контакта (связывание с рецептором) с патогеном недостаточно. Должна произойти презентация антигена.
Презентацию антигена осуществляют специальные антиген-презентирующие клетки (АПК), к которым относятся макрофаги и дендритные клетки (рис. 5), при этом В-лимфоцит должен получить сигнал к активации от Т-хелпера. Взаимодействие клеток происходит через ряд мембранных белков. Помимо иммуноглобулина, в нем участвуют главный комплекс гистосовместимости, Т-клеточный рецептор и ряд корецепторов.
Рис. 5. Взаимодействие между антиген-презентирующей (дендритной) клеткой и лимфоцитом.
Все клетки организма имеют на поверхности специальные гликопротеины – главный комплекс гистосовместимости (ГКГ, major histocompatibility complex, MHC, HLA). Этот гликопротеин существует в двух вариантах. ГКГ II имеют АПК и В-лимфоциты, ГКГ I – все остальные, в том числе и соматические, клетки. Этот комплекс индивидуален и насчитывает примерно 2000 аллельных генов. Внутри каждой клетки происходит постоянное обновление белков и других полимеров. Старые молекулы разрушаются и их фрагменты «выкладываются» на поверхность ГКГ. Иммунные клетки в процессе созревания «учатся» распознавать свой ГКГ и белки, которые на нем находятся. Таким образом, ГКГ являются «паспортом» клетки и показывают не только ее принадлежность данному организму, но и что происходит внутри клетки.
Т-лимфоциты обнаруживают патоген с помощью своих Т-клеточных рецепторов (ТКР, T-cell receptor, TCR). Это мембранный белок, ответственный за распознавание процессированных антигенов, связанных с молекулами главного комплекса гистосовместимости (рис. 6). Этот рецептор, как и антитела, имеет конститутивный и вариабельный участки. Конститутивным участком он связан с мембраной Т-лимфоцитов, вариабельный участок необходим для распознания ГКГ, антигена, и он индивидуален для каждого Т-лимфоцита.
Рис. 6. Взаимодействие Т-клеточного рецептора и главного комплекса гистосовместимости.
Для нормальной работы Т-лимфоцитов, при созревании в тимусе они проходят сложный двухэтапный отбор. На первом этапе выживают только те Т-лимфоциты, которые остаются способны связываться с ГКГ вариабельным участком ТКР (положительный отбор). На втором – уничтожаются Т-лимфоциты, которые активируются в ответ на собственные антигены, «выложенные» на ГКГ. Параллельно с этим, идет дифференцировка на Т-киллеры и Т-хелперы. Т-киллеры должны взаимодействовать с ГКГ I, в качестве корецептора такого взаимодействия выступает мембранный белок CD4, он и является маркером Т-киллеров. Т-хелперы должны связываться с ГКГ II, в качестве корецептора и маркера выступает белок CD8.
Если отбор Т- и В-лимфоцитов прошел недостаточно строго, и остались клетки, реагирующие на собственные антигены организма, то иммунитет может начать атаковать собственные клетки, что приведет к возникновению аутоиммунных заболеваний.
Презентация антигена В-лимфоцитам – это сложный процесс, в котором принимают участие Т-хелперы и АПК. В-лимфоцит, не взаимодействовавший со своим антигеном называется наивным. Если антиген взаимодействует с мембранным антителом В-лимфоцита, то происходит интернализация антитела с антигеном, антиген разрушается на фрагменты, и они выкладываются на ГКГ II. В это время, макрофаг или дендритная клетка также должны захватить антиген. Они его переваривают и выкладывают на ГКГ II. Т-хелпер должен провзаимодействовать с ГКГ II на поверхности АПК, после чего происходит его активация. Только после этого, Т-лимфоцит может провзаимодействовать с ГКГ II на поверхности В-лимфоцита, который активируется и превращается в плазматическую клетку. Плазматическая клетка пролиферирует и создает клонов, которые синтезируют антитела той же специфичности, что и исходный лимфоцит. Таким образом, происходит усиление иммунного ответа. Стоит отметить, что один патоген имеет много эпитопов, вследствие чего активируется множество В-лимфоцитов с различной специфичностью. Часть В-лимфоцитов, после контакта с патогеном, превращается в клетки памяти, которые сохраняются после болезни, и их активация происходит гораздо быстрее при повторном контакте с антигеном.
Рис. 7. Презентация антигена. Сверху: чужеродный антиген (1) захватывает и поглощает антиген-презентирующая клетка (2), которая его расщепляет и частично экспонирует на своей поверхности в комплексе с молекулами ГКГ II (3). Внизу весь чужеродный антиген связывается поверхностными антителами (5) В-лимфоцита (6), также поглощается и процессируется им (7), после чего часть чужеродной молекулы презентируются в комплексе с молекулами ГКГ II (8). После контакта (10) с Т-лимфоцитом (хелпером, 4), уже активированным антиген-презентирующей клеткой (2), В-лимфоцит начинает секретировать антитела в кровь (9).
Т-киллеры отвечают за клеточный иммунитет. Они играют важную роль в защите организма против вирусов и опухолей. Т-киллеры взаимодействуют с ГКГ I всех клеток и уничтожают клетку в случаях обнаружения чужого ГКГ или фрагмента чужого антигена на ГКГ. Таким образом, они уничтожают раковые клетки и внутриклеточных паразитов. Т-киллеры играют важную роль при трансплантации органов, ведь именно эти клетки атакуют чужеродные ткани пересаженного органа. Поэтому при трансплантации стараются подобрать донора органов, клетки которых имеют максимально похожий ГКГ на ГКГ пациента.
Т-киллеры взаимодействуют с клеткой через ГКГ, и, если он отсутствует, то клетка остается невидимой для этой системы. Поэтому, клетки без ГКГ уничтожаются натуральными киллерами. Таким образом, они обеспечивают противоопухолевую защиту.
Помимо лимфоцитов, в плазме крови присутствуют белки, способные распознавать клеточную стенку бактерий и самособираться в пору, вследствие чего нарушается ионный баланс клетки, и она погибает. Такие белки относятся к системе комплемента. Они синтезируются печенью и относятся к группе глобулинов.
Наличие на поверхности антигена антител или белков системы комплемента является сигналом для макрофагов к фагоцитозу чужеродной частицы.
Проявления иммунитета разнообразны и включает множество клеток и белков. Она обеспечивает эффективную защиту организма от различного рода заражений. Однако, приобретенный иммунитет – это эволюционно новая система, которая присутствует только у позвоночных. Именно поэтому нередки случаи некорректной работы иммунитета, что может привести к различным патологиям, например, аллергиям, опухолям и аутоиммунным заболеваниям.
Вакцины и вакциноуправляемые заболевания
В мире существует огромное количество опасных для человека вирусов и бактерий. Благодаря вакцинации некоторые заболевания (например, натуральную оспу) удалось победить. Другие же инфекции находятся под контролем — возбудители циркулируют в окружающей среде, но вспышки, эпидемии возникают редко.
К сожалению, инфекции невозможно предупредить с помощью правильного питания, закаливания и т.д. Вакцинация – единственная возможность защитить детей и взрослых от болезни.
Ниже приведены распространенные вакциноуправляемые инфекции:
- Туберкулез. Поражает легкие и бронхи, реже — суставы, мочеполовую систему. Опасен развитием генерализованных форм, менингита. Микобактерия туберкулеза чрезвычайно устойчива к большинству препаратов.
- Коклюш – заболевание, поражающее дыхательные пути. Токсины возбудителя раздражают кашлевой центр, провоцируя приступы мучительного кашля с остановкой дыхания, рвотой. Может осложняться поражением головного мозга, эписиндромом.
- Дифтерия – болезнь, при которой токсины возбудителя циркулируют в крови, оказывая губительное действие на сердечно-сосудистую, нервную систему. Чаще у больных формируется круп – плотная пленка на миндалинах, перекрывающая просвет дыхательных путей. Среди осложнений – шок, параличи мягкого нёба, поражения сердца, почек.
- Полиомиелит- это острая кишечная инфекция, при которой страдает ЦНС. Нарушается дыхание, развиваются парезы и параличи. Изменения носят стойкий характер, более 80% переболевших остаются инвалидами. Вылечить это заболевание практически невозможно.
- Корь – чрезвычайно заразное вирусное заболевание. Поражает дыхательные пути с развитием бронхита, ложного крупа, пневмонии. Нередко страдает центральная нервная система – менингит, энцефалит. Возможно развитие глухоты. Специфического лечения от кори нет, летальность среди непривитых детей высока.
- Краснуха — вирусная инфекция, для которой характерна кожная сыпь, увеличение лимфоузлов, лихорадка. Наиболее опасна для будущих мам – заражение приводит к тяжелым порокам развития (пороки сердца, глухота).
- Столбняк – инфекционное заболевание, при котором токсины бактерии оказывают токсическое действие на нервную систему. Смерть наступает от паралича дыхания, сепсиса, инфаркта миокарда. Летальность высока. Входными воротами служат поврежденный кожный покров (раны, ссадины и т.д.) – это означает, что случайно заразиться может каждый.
- Эпидемический паротит («свинка») – воспаление околоушных слюнных желез. Чаще болеют дети; может протекать тяжело – у каждого десятого развивается менингит, возможна потеря слуха. У мальчиков, перенесших «свинку», нередко возникает воспаление яичка, что приводит к нарушению детородной функции.
- Вирусный гепатит В распространяется половым, контактно-бытовым путем, при медицинских манипуляциях, через плаценту. Заболевание в 60-90% носит хронический характер и приводит к циррозу или первичному раку печени.
Антитело-опосредованный иммунитет-пример RSV-инфекции
Необходимы ли антитела?
У детей без антител (Х-связанная агаммаглобулинемия) не описывается никакого тяжелого течения RSV-инфекций. Также на мышиной модели животные с отсутствием В-клеток проявляли кинетику элиминации вируса сравнимую с таковой иммуно-компетентных животных. Как и у большинства вирусов, антитела при первичной инфекции RSV также не играют никакой роли. Интересно, что при вторичной инфекции лишенных В-клеток животных вирус очень быстро элиминировался. Это одна-ко часто связано с более тяжелым течением заболевания. Антитела таким образом не безусловно необходимы для защитного иммунитета против RSV. Очевидно, что необходим сбалансированный В- и Т-клеточный иммунитет, чтобы не только воспрепятствовать распространению вируса, но также и для предотвращения клинического заболевания. Однако корреляция между материнскими уров-нями нейтрализирующих RSV-антител и тяжестью детского заболевания после инфекциии была об-наружена не во всех исследованиях. Защита от RSV-заболевания антителами становится очевид-ней при профилактическом действии RSV-специфических антител таких как Respigam или Palivizu-mab. При регулярном приеме Palivizumab (нейтрализирующие IgG-антитела против RSV-поверхностного протеина) удалось снизить уровень связанных с RSV регоспитализаций недоно-шенных детей на 50% . Можно ли эти результаты улучшить путем оптимизации антител и их при-менения (доза и интервал), в настоящее время интенсивно изучается. Тот факт, что даже после ес-тественной RSV инфекции, несмотря на высокий уровень нейтрализирующих анттел, возможна RSV-реинфекция, в совокупности с ограниченной эффективностью материнских или трансфундиро-ванных антител, говорит скорее против того, что достаточно одних антител.
Почему антитела имеют ограниченную эффективность? Как было сказано выше, как только вирус инфицирует целевую клетку, антитела далее остаются бездейственны. Кроме того, RSV в результа-те клеточных фузий может распространяться от клетки к клетке, без необходимости экстрацеллю-лярной фазы. Являются IgA вероятно более эффективными, чем IgG, известно недостаточно. В мышиной модели однако интратрахеально вводимый RSV-специфический IgA оказался менее эф-фективным, чем IgG. Нет никаких указаний на то, что пациенты с дефицитом IgA чаще и тяжелее страдают от RSV-заболеваний.
Может ли быть индуцирован В-клеточный иммунитет в присутствии антител?
Это важный вопрос в отношении каждой вакцины, которая вводится в течение первых месяцев жизни, может ли она, даже в присутствии материнских антител (или в случаев RSV, даже при на-личии профилактически вводимых антител), вызывать адекватную реакцию памяти. В отношении этого имеются хорошие сведения полученные на мышиной модели о том, что присутствие мате-ринских антител препятствует тому, чтобы живая вакцина RSV в достаточном размере активирова-ла детские В-клетки. При реинфекции уже нет достаточного уровня нейтрализирующих антител способных быстро противостоять репликации вируса.
Как Т-клетки опосредуют антивирусный иммунитет?
Т-клетки — это лимфоциты, которые через высокоспециализированные рецепторы могут распозна-вать инфицированные целевые клетки. Все ядросодержащие клетки располагают энзиматическим аппаратом, который может расщеплять интрацеллярно синтезированные протеины на пептидные фрагменты. Эти фрагменты могут связываться с МНС-молекулой и транспортироваться на поверх-ность клетки.
Таким образом вирус-инфицирвоанная клетка представляет вирусные фрагменты Т-клеткам (рис. 4). Контакт Т-клеточных рецепторов с комплексом из МНС и вирусного пептида при-водит, в совокупности с ко-стимулирующиими сигналами, к активации Т-клеток. К чему относится клональная пролиферация , дифференцировка и активация антивирусных эффекторных механиз-мов. Т-клетки опосредуют антивирусные эффекторные функции через секрецию цитокинов, таких как интерферон- и тумор-некротизирующий фактор (TNF) или зависимую от контакта цитотоксич-ность (рис. 5). Названные цитокины могут или индуцировать рецепторопосредованные интрацел-лярные антивирусные эффекторные механизмы, или активировать другие эффекторные клетки, та-кие как макрофаги. CD4+ — T-клетки действуют в основном через цитокины, тогда как в основном CD8+-T-клетки проявляют и цитотоксическую функцию. Важным молекулярным механизмом при этом является перфорин-опорседуемая индукция клеточной смерти, CD95-опосредованный апоптоз играет вероятно в контроле за вирусной инфекцией меньшую роль. Т-клетки не могут таким обра-зом распознавать свободных вирусов, но способны через распознание и разрушение инфициро-ванных клеток создавать стеризирующий иммунитет.
Исследование антивирусных Т-клеток и их функций у человека, несмотря на значительный методи-ческий прогресс достигнутый за последние годы, еще не удовлетворительно. Хотя благодаря при-менения МНС-пептид-тетрамеров или ELISPOT-метода стало возможным вести подсчет антивирус-ных Т-клеток. Особенно в отношении вакцианльного иммунитета нет никаких хорошо поддающихся измерению параметров, которые бы указывали, в достаточной ли степени вакцина индуцировала Т-клеточный иммунитет, чтобы предохранить от клинического заболевания.
Важная информация о вакцинации
Задумываясь, делать ли прививку себе, ребенку, взрослые переживают о безопасности препаратов, интересуются возможными противопоказаниями, считают, что национальный календарь «перегружен».
Насколько безопасны вакцины? В состав вакцин обычно входят следующие компоненты:
- Антиген. Это может быть живая, убитая форма вируса, бактерии или фрагменты возбудителя. Этот компонент «учит» иммунитет распознавать врага и вырабатывать на него антитела.
- Консерванты и стабилизаторы для защиты антигенов при перевозке или хранении. Существуют вакцины без консервантов; они применяются в детской практике.
- Некоторые препараты содержат вещества-адъюванты, усиливающие иммунный ответ.
Каждая вакцина проходит несколько этапов клинических исследований: изучается безопасность, метаболизм, способы выведения, частота и выраженность нежелательных эффектов. Далее оценивается иммуногенность — способность стимулировать синтез антител в ответ на введение. Этот параметр свидетельствует об эффективности препарата и оценивается в процентах. Например, при введении вакцины от гриппа антитела вырабатываются у 95% привитых. Чем выше иммуногенность, тем больше вероятность, что население будет защищено от эпидемии заболевания.
Безопасная и эффективная вакцина может быть допущена в массовое производство и рекомендована к применению. После регистрации препарата клиницисты продолжают наблюдать за нежелательными эффектами.
Популярные гипотезы о связи прививок и таких заболеваний как аутизм, ДЦП, эпилепсия не имеют научного подтверждения. Нередко тяжелые психические и неврологические расстройства впервые проявляют себя после 1 года вне зависимости от того, был вакцинирован малыш или нет.
Влияет ли стресс на иммунитет?
Да, каким-то образом влияет, но этот механизм гораздо более сложный, чем думают многие. Если просто понервничать или даже подвергнуться какой-то сложной психотравмирующей ситуации, это, скорее всего, не ухудшит показатели иммунитета заметным образом. Организм, как правило, адаптируется к стрессовым нагрузкам. Но длительное, постоянное нахождение в стрессовой ситуации может действительно повлиять на иммунную систему. Вопрос о том, как именно взаимосвязаны уровень психологического стресса, иммунная система и заболеваемость, пока недостаточно изучен.
Можно ли вводить несколько вакцин одновременно?
Мамы грудных детей переживают, что прививки «убивают» собственный иммунитет и могут причинить вред при одновременном введении. В действительности каждый человек ежедневно сталкивается с десятками и сотнями бактерий и вирусов, а его иммунитет успешно справляется с ними.
Двух-, трех- , четырех-, и пятикомпонентные вакцины хорошо переносятся детьми и помогают выработать иммунитет к тому времени, когда малыши будут посещать дошкольные учреждения, кружки или секции. Получить полную информацию о порядке введения препаратов можно у педиатра.
А как насчет витаминов и полезных йогуртов?
Витамины как таковые действительно нужны для иммунитета. Так, витамины A, С, D, E и B6 активно участвуют в иммунных процессах, когда их недостаточно, нарушается активация T и B-лимфоцитов. Но это не значит, что мультивитамины могут помочь поднять иммунитет: Синтетические витамины усваиваются хуже, чем те, которые мы получаем с пищей, поэтому ВОЗ рекомендует принимать отдельные витамины лишь при их недостатке, а в общем случае просто полноценно питаться.
Доказано, что витамин С также не обладает защитными или иммуномодулирующими действиями и не способен защитить от ОРВИ или улучшить его течение.
Лактобактерии и другие пробиотики, содержащиеся в йогуртах, не укрепляют иммунитет и не помогают нам меньше болеть. Эти бактерии просто не задерживаются в кишечнике: они разлагаются в кислой среде за 1-2 дня.
Когда следует воздержаться от прививки?
Некоторым людям следует отложить вакцинацию или полностью отказаться от нее. В качестве временных противопоказаний выступают:
- лечение онкологического заболевания (курс химиотерапии);
- декомпенсация тяжелых хронических заболеваний;
- острые инфекционные заболевания;
- беременность и кормление грудью (но не все вакцины, например против гриппа можно привиться во 2-3 триместре беременности);
- период менее 1 месяца от последней прививки.
Но существуют и такие состояния, при которых вакцинация может причинить вред здоровью. Это:
- аутоиммунные заболевания;
- эпилепсия, судорожный синдром;
- аллергия на компоненты вакцины;
- плохая переносимость предыдущей дозы вакцины.
Перед введением препарата врач осматривает пациента, измеряет температуру тела, собирает эпидемиологический анамнез.
Недостатки пассивной иммунизации
- Производство антител является дорогостоящим, однако новые технологии могут помочь производить их в лаборатории, особенно антитела к инфекционным заболеваниям, которые необходимо собирать из крови тысяч доноров или даже получать из крови иммунных животных.
- Антитела животных могут вызвать у реципиента серьезные аллергические реакции.
- Антитела необходимо вводить путем внутривенной инъекции, что может быть сложной процедурой и требует много времени, чем инъекция вакцины.
- Иммунитет, обеспечиваемый пассивной иммунизацией, недолговечен, то есть не приводит к образованию долговременных иммунных клеток памяти.
Можно ли делать прививки во время беременности?
Беременность сама по себе не является противопоказанием к направлению на прививку. Следует различать плановые и экстренные вакцинации.
В плановом порядке рекомендована прививка от сезонного гриппа. Так прививка от гриппа не только разрешена, но и рекомендована. Она снижает вероятность заболевания малыша первого полугода жизни на 60-65%.
В экстренном порядке возможна лечебно-профилактическая прививка от бешенства, при укусах животными. Врач сопоставляет опасность вакцинации и риск развития смертельно опасного заболевания.
Вакцинация – самый эффективный и безопасный способ защиты взрослых и детей от опасных инфекций. Перечень рекомендуемых вакцин указан в Национальном календаре прививок. Уточнить информацию о порядке введения, правилах подготовке к вакцинации и возможных нежелательных эффектах можно у своего лечащего врача.
Укрепляет ли закаливание иммунитет?
Нет, не укрепляет. Но оно полезно по другим причинам. Организм, привыкший к воздействию холода, не воспринимает случайный сквозняк как экстренный режим «переохлаждения», так как его сосуды в хорошем тонусе, они быстро реагируют на перепады температуры. Спазма сосудов не возникает, не снижается кровоснабжение слизистой оболочки дыхательных путей, и условно-патогенные микроорганизмы, живущие в нашей носоглотке, не активизируются. А значит, там, где незакаленный человек «простудится», закаленный не заболеет. Вместе с тем, заразиться ОРВИ и тот и другой могут с абсолютно одинаковой вероятностью.